
|
| ļ¬®ņĀü ļ░Å ļ▓öņ£ä Aims and Scope |
| ņĀĆļäÉ ņĀĢļ│┤ About the Journal |
| ĒÄĖņ¦æņ£äņøÉĒÜī Editorial Board |
| Open Access |
| ĒÄĖņ¦æĻĄŁ Editorial Office |


|
| ļ¬®ņĀü ļ░Å ļ▓öņ£ä Aims and Scope |
| ņĀĆļäÉ ņĀĢļ│┤ About the Journal |
| ĒÄĖņ¦æņ£äņøÉĒÜī Editorial Board |
| Open Access |
| ĒÄĖņ¦æĻĄŁ Editorial Office |

Cited By
Citations to this article as recorded by Effect of Potassium Carbonate Additives on the Properties of Copper Foils Electroplated at High Current Density
Tae-Gyu Woo, Il-Song Park
Korean Journal of Metals and Materials.2023; 61(5): 347. CrossRef Effects of JGB Additives on the Microstructures and Electrical Properties of Electroplated Copper Foil
Tae-Gyu Woo, Il-Song Park
Korean Journal of Metals and Materials.2021; 59(6): 404. CrossRef AbstractIn this study, we studied the surface and mechanical properties of multiple additives as well as the initial plating properties of individual additives. With the individual additive groups, copper crystals tended to converge at a stage above the critical amount of additive. When chloride ions were added, large crystals formed at several places on the surface. Thereafter, small crystals were attached to and grew on the surface of the large crystals. When collagen and JGB (Janes Green B) were added individually, the crystals were more uniformly distributed on the surface as compared with the group with added chloride ions. In addition, starlike crystals were grown depending on the amount of addition. It was necessary to use multiple additives, which is why it is difficult to make a uniform surface layer with individual additives. Large crystals of more than 10 ╬╝m formed unevenly on the surface treated with multiple additives of chloride ions and MPSA (3-mercapto-1-propane sulfonic acid). Large crystals disappeared on the surface treated with additional collagen along with multiple additives. However, valley like shapes were observed on this surface, due to the large crystals. But, addition of JGB additives to this reduced the valley and formed a uniform plating layer. MPSA and 20 ppm of collagen were added as multiple additives, grain sizes increased by 93.5% (220 peak) and 172.3% (311 peak) compared with the non-additive group. As a result, tensile strength decreased by 24.5% and elongation increased by 17.8%. The crystal size was reduced 25.0% on average by the addition of 10 ppm JGB, which contributed to a 5.4% increase in tensile strength and a 16.0% decrease in elongation. The grain size and surface properties could be controlled by adding multiple combinations of additives. As a result, It was confirmed that mechanical properties could be controlled by the proper amount and the optimum combination of additives.
1. ņä£ ļĪĀ4ņ░© ņé░ņŚģĒśüļ¬ģņØś ļŗżņ¢æĒĢ£ ņé░ņŚģļ░£ņĀäļČäņĢ╝ ņżæ ĒĢśņØ┤ļĖīļ”¼ļō£ ņĀäĻĖ░ņ×ÉļÅÖņ░©(HEV), ņ╣£ĒÖśĻ▓Į ņŚÉļäłņ¦Ćņé░ņŚģ, IT, ņ¦ĆļŖźĒśĢ ļĪ£ļ┤ćņé░ņŚģ ļō▒ņØś ļ░£ņĀäņŚÉ ļö░ļØ╝ ņØ┤ļōżņØś ĒĢĄņŗ¼ ļČĆĒÆłņØĖ ņØ┤ņ░©ņĀäņ¦Ć ņØīĻĘ╣ ņåīņ×¼ņØś ņä▒ļŖź Ē¢źņāüņØ┤ ņĀłņŗżĒ׳ ņÜöĻĄ¼ļÉśĻ│Ā ņ׳ļŗż [1]. ņØ┤ņ░©ņĀäņ¦ĆņØś ņØīĻĘ╣ņ×¼ļŻīļĪ£ ņé¼ņÜ®ļÉśļŖö ļÅÖļ░ĢņØĆ electromigration(EM)ņŚÉ ļīĆĒĢ£ ņÜ░ņłśĒĢ£ ņĀĆĒĢŁņä▒ ļ░Å ņŚ┤ ņĀäļÅäņä▒, ĻĖ░Ļ│äņĀü ļ¼╝ņä▒ņØś ņÜ░ņłśņä▒, ļé«ņØĆ ņĀäĻĖ░ ņĀĆĒĢŁ(1.67 ╬╝╬®-cm) ļō▒ņØś ņןņĀÉņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ņé¼ņÜ®ņØ┤ ĒÖĢļīĆļÉśĻ│Ā ņ׳ļŗż. ĒŖ╣Ē׳ ņĀäĒĢ┤ļÅÖļ░ĢņØĆ ņĢĢņŚ░ļ░Ģ ļīĆļ╣ä ņé¼ņÜ®ņ▓śņŚÉ ļ¦×Ļ▓ī ļæÉĻ╗ś ļ░Å ĻĖĖņØ┤ ņĪ░ņĀłņØ┤ ņÜ®ņØ┤ĒĢśļ®░ ņāØņé░ĒĢĀ ņłś ņ׳ļŖö ĒÅŁņØ┤ ļäōņ¢┤ ņāüļīĆņĀüņ£╝ļĪ£ ņāØņé░ļ╣äņÜ®ņØ┤ ņĀüĻ▓ī ļōżņ¢┤ ļÅÖļ░Ģ ņāØņé░ ļ░®ņŗØņ£╝ļĪ£ ņĀüĒĢ®ĒĢśļŗż [2-6].
ņĀäĒĢ┤ļÅäĻĖłļ▓ĢņŚÉ ņŻ╝ļĪ£ ņØ┤ņÜ®ļÉśļŖö ļÅäĻĖłņÜĢ ņżæ ĒÖ®ņé░-ĒÖ®ņé░ĻĄ¼ļ”¼ ņĀäĒĢ┤ņĢĪņØĆ ļé«ņØĆ ļÅģņä▒, ļ╣äĻĄÉņĀü ļ╣ĀļźĖ ļÅäĻĖłņåŹļÅä, ļé«ņØĆ ņāØņé░ļ╣äņÜ®, ĻĘĖļ”¼Ļ│Ā ļÅäĻĖł Ēøä ļ░Ģļ¦ēņØś ņ£ĀņŚ░ņä▒ ļ░Å Ļ░ĢļÅä ĻĘĀņØ╝ņä▒ ļō▒ņØś ņןņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ļÅÖļ░Ģ ņāØņé░ ļÅäĻĖłņÜĢņ£╝ļĪ£ ļäÉļ”¼ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż [7-9]. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĀäĒĢ┤ļÅÖļ░ĢņØś ņĀ£ņĪ░Ļ│ĄņĀĢņŚÉņä£ ņØīĻĘ╣ņ×¼ļŻīļĪ£ļŖö ĒāĆņØ┤ĒāĆļŖä ļō£ļ¤╝(Ti drum)ņØä ņØ┤ņÜ®ĒĢ£ļŗż. ĒāĆņØ┤ĒāĆļŖäņØĆ ļÅäĻĖł Ēøä ļ░Ģļ”¼ņĀ£ ņŚåņØ┤ ļ░Ģļ¦ēņØä ņēĮĻ▓ī ļ¢╝ņ¢┤ ļé╝ ņłś ņ׳Ļ│Ā ĒÖ®ņé░-ĒÖ®ņé░ĻĄ¼ļ”¼ ņĀäĒĢ┤ņĢĪ ļé┤ņŚÉņä£ ļČĆņŗØņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØ┤ Ēü¼ĻĖ░ņŚÉ ņé¼ņÜ® ĒøäņŚÉ ļ¦ÄņØĆ ņ▓śļ”¼ļź╝ ĒĢśņ¦Ć ņĢŖĻ│Ā ņ×¼ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗżļŖö ņןņĀÉļōżņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ļÅäĻĖłĻ│ĄņĀĢņŚÉņä£ ļäÉļ”¼ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż [10]. ņĀäĒĢ┤ļÅäĻĖłļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļÅÖļ░Ģ ņĀ£ņĪ░ ņŗ£ Ēæ£ļ®┤ ĒśĢņāüĻ│╝ ĻĄ¼ņĪ░ ļ░Å ņĀäĻĖ░ņĀü ĒŖ╣ņä▒ņŚÉ ļ»Ėņ╣śļŖö ņØĖņ×ÉļĪ£ļŖö ņĀäĒĢ┤ņĢĪ ņł£ļÅä, ņĀäĻĘ╣ Ļ░äĻ▓®, ņ£ĀņåŹ, ļÅäĻĖłņĢĪņØś ņś©ļÅä, ņØīĻĘ╣ ņĀäņĢĢ, ĻĄÉļ░śņĪ░Ļ▒┤, ņĀäļźśĒīīĒśĢ, ņĀäļźśļ░ĆļÅä ļō▒ņØś ļŗżņ¢æĒĢ£ Ļ│ĄņĀĢļ│ĆņłśĻ░Ć ņ׳ņ£╝ļ®░, ņé¼ņÜ®ĒĢśļŖö ņåīņ×¼ņØś ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ ņ£ĀĻĖ░ņ▓©Ļ░ĆņĀ£ļź╝ ņ▓©Ļ░Ćļź╝ ĒåĄĒĢ┤ ļÅÖļ░ĢņØś ĒŖ╣ņä▒ņØä ņĀ£ņ¢┤ĒĢśļŖö Ļ▓āņØ┤ Ļ░ĆļŖźĒĢśļŗż [6,11-15]. ļśÉĒĢ£ ņāØņé░ļ¤ē ņ”ØĻ░Ćļź╝ ņ£äĒĢśņŚ¼ Ļ│ĀņĀäļźśļ░ĆļÅäņŚÉ ņĀüņÜ® Ļ░ĆļŖźĒĢ£ ņ▓©Ļ░ĆņĀ£ Ļ░£ļ░£ņØ┤ ļ¦żņÜ░ ņżæņÜöĒĢ┤ņ¦ĆĻ│Ā ņ׳ļŗż. ņĀäĒĢ┤ņĢĪņŚÉ ņ▓©Ļ░ĆļÉ£ ppmļŗ©ņ£äņØś ņĀüņØĆņ¢æņØś ņ£ĀĻĖ░ ņ▓©Ļ░ĆņĀ£(ļČäņ×É)ļŖö ļåÆņØĆ Ē£śļÅäļź╝ Ļ░¢ļŖö ĻĘĀņØ╝ĒĢ£ ņĀäņ░®ņĖĄ ĒśĢņä▒ņØä ņ┤ēņ¦äņŗ£ĒéżĻ│Ā, ņĀäĒĢ┤ļÅÖļ░Ģ ĻĄ¼ņĪ░ ļ░Å ĻĖ░Ļ│äņĀü ĒŖ╣ņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗż [16]. ĻĘĖļ¤¼ļéś ļåÆņØĆ ņĀäļźśļ░ĆļÅäņØś ņŚ░ņåŹ ņĀäĒĢ┤ļÅäĻĖł Ļ│ĄņĀĢņŚÉņä£ ņ▓©Ļ░ĆņĀ£ņŚÉ ņØśĒĢ£ ĻĄ¼ļ”¼ņØś ĒĢĄņāØņä▒ ļ░Å Ļ▓░ņĀĢņä▒ņןņØ┤ ņ¢┤ļ¢╗Ļ▓ī ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖöņ¦ĆņŚÉ ļīĆĒĢ£ ļ®öņ╗żļŗłņ”śņØĆ ņĢäņ¦ü ĻĘ£ļ¬ģļÉśņ¦Ć ņĢŖņØĆ ļČĆļČäņØ┤ ļ¦Äļŗż.
ņĀäĒĢ┤ļÅÖļ░Ģ ņĀ£ņĪ░ņĪ░Ļ▒┤ņŚÉņä£ ĻĄ¼ļ”¼ņØś ĒĢĄņāØņä▒Ļ│╝ Ļ▓░ņĀĢņä▒ņןņŚÉ ļīĆĒĢ£ ņłśĒ¢ēļÉ£ ņŚ░ĻĄ¼ņŚÉ ļīĆĒĢśņŚ¼ ņé┤ĒÄ┤ļ│┤ļ®┤, Dutra ļ░Å Leeļō▒ [17, 18]ņØĆ ņĀżļØ╝Ēŗ┤Ļ│╝ ņŚ╝ņåīņØ┤ņś©ņØä ņ▓©Ļ░ĆĒĢśņŚ¼ļÅä ĻĄ¼ļ”¼ņØś ĒĢĄņāØņä▒ ĻĖ░ĻĄ¼ņŚÉ ļ»Ėņ╣śļŖö ĒÜ©Ļ│╝ļŖö ļ»Ėļ╣äĒĢśņ¦Ćļ¦ī ņ▓©Ļ░ĆņĀ£ņÖĆ ĻĄÉļ░śņŚÉ ņØśĒĢ┤ņä£ ĻĄ¼ļ”¼Ļ▓░ņĀĢņØś ļ»ĖņäĖĻĄ¼ņĪ░ņÖĆ ĻĖ░Ļ│äņĀü ņä▒ņ¦ł, Ēæ£ļ®┤ļ░ĆļÅä ĻĘĖļ”¼Ļ│Ā Ļ▓░ņĀĢņä▒ņן ļ░®ņ£ä ļō▒ņØĆ ļ│ĆĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś Stantke [19]ņØś ņŗżĒŚśĻ▓░Ļ│╝ ņĀżļØ╝Ēŗ┤ņØĆ ņĀäĒĢ┤ņĢĪ ļé┤ņŚÉņä£ ņ┤łĻĖ░ņŚÉļŖö ņ¢ĄņĀ£ņĀ£ ņŚŁĒĢĀņØä ĒĢśņ¦Ćļ¦ī 10~50ļČäņØ┤ Ļ▓ĮĻ│╝ĒĢ£ ņØ┤ĒøäņŚÉļŖö ņØ┤ļ¤¼ĒĢ£ ļČäĻĘ╣ĒÜ©Ļ│╝Ļ░Ć ņāüļŗ╣Ē׳ Ļ░ÉņåīĒĢ£ļŗżĻ│Ā ĒĢśņśĆļŗż. Kim ļō▒ [4,20]ņØĆ ņĀżļØ╝Ēŗ┤Ļ│╝ ņŗĖņØ┤ņśżņÜöņåī(thiourea)ļŖö ĻĄ¼ļ”¼ ļ░Ģļ¦ēņØś Ēæ£ļ®┤ņĪ░ļÅä ļ░Å Ļ▒░ņ╣ĀĻĖ░ļź╝ Ļ░£ņäĀĒĢśĻĖ░ ņ£äĒĢ┤ ļ¬®ņĀü ļ░Å ĻĄ¼ļ”¼ļ░Ģļ¦ēņØś ļČĆņŗØļ░®ņ¦Ćļź╝ ņ£äĒĢ£ ņ▓©Ļ░ĆņĀ£ļĪ£ ņé¼ņÜ®ĒĢ£ļŗżĒĢśņśĆļŗż. Park ļō▒ [21,22]ņØĆ JGB(Janes Green B)ļŖö Cl- Ļ│╝ NH4+ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ņ£╝ļ®░, ĻĄ¼ļ”¼ ņĀäņ░®ļ¼╝Ļ│╝ NH4+ ņØ┤ņś©ņØĆ ļÅīņČ£ļČĆņŚÉ ņÜ░ņäĀņĀüņ£╝ļĪ£ ĒØĪņ░®ĒĢśņŚ¼ ļÅīņČ£ļČĆņŚÉņä£ņØś ĻĄ¼ļ”¼ņØ┤ņś©ņØś ņĀäņ░®ņØä ņ¢ĄņĀ£ĒĢśļŖö ļÅÖņŗ£ņŚÉ, ĒĢ©ļ¬░ļČĆņŚÉņä£ņØś ĻĄ¼ļ”¼ņØ┤ņś©ņØś ņĀäņ░®ņØä ņ£ĀļÅäĒĢśņŚ¼ ĒÅēĒāäĒĢ£ ĻĄ¼ļ”¼ ļÅäĻĖłņĖĄņØä ļ¦īļōĀļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņĀüņĀłĒĢ£ JGB ņ▓©Ļ░ĆņĀ£ņØś ņ▓©Ļ░ĆļŖö ĻĄ¼ļ”¼ ņĀäņ░®ņĖĄ Ēæ£ļ®┤ņØä ĒÅēĒāäĒĢśĻ▓ī ļ¦īļōż ņłś ņ׳ļŗżĒĢśņśĆļŗż. Cl- ņØĆ ĻĄ¼ļ”¼ ņĀäņ░®ņĖĄ Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ĒĢśņŚ¼ ĻĄ¼ļ”¼ ņØ┤ņś©Ļ│╝ ņĀäņ░®ņĖĄ Ēæ£ļ®┤ņØś Ļ▒░ļ”¼ļź╝ ņżäņŚ¼ņŻ╝ļŖö Ļ░ĆĻĄÉ ņŚŁĒĢĀņØä ĒĢśļ®░ Cl- ņØś ĒØĪņ░®ņĖĄņØĆ ĻĄ¼ļ”¼ ĒÖśņøÉņżæ ņåŹļÅäĻ▓░ņĀĢļŗ©Ļ│äņØĖ Cu2+ ŌåÆ Cu+ ļ░śņØæņØś ņĀäĒĢśņĀäļŗ¼ ņåŹļÅäļź╝ ņ┤ēņ¦äĒĢśņŚ¼ ĻĄ¼ļ”¼ ĒÖśņøÉ ņåŹļÅäļź╝ Ļ░ĆņåŹĒĢ£ļŗż [23,24]. ļśÉĒĢ£ ņ£ĀĻĖ░ ņ▓©Ļ░ĆņĀ£ļź╝ ņŚ╝ĒÖöņØ┤ņś©Ļ│╝ ĒĢ©Ļ╗ś ņ▓©Ļ░ĆĒĢĀ Ļ▓ĮņÜ░, ņŚ╝ĒÖö ņØ┤ņś©ņØś ĒØĪņ░®ņĖĄņØĆ ņŗĖņØ┤ņśżņÜöņåī, PEG, SPS ļō▒ņØś ļŗżņ¢æĒĢ£ ņ▓©Ļ░ĆņĀ£ņÖĆ ļ│ĄĒĢ®ņ▓┤ļź╝ ĒśĢņä▒ĒĢśņŚ¼ ņ▓©Ļ░ĆņĀ£ņØś ĒØĪņ░®ņØä ļÅĢļŖöļŗżĒĢśņśĆļŗż [25-26]. ņ£ĀĻĖ░ņ▓©Ļ░ĆņĀ£ļŖö ņØ┤ļ»Ė ļÅäĻĖłņØś ņé░ņŚģĒÖöņÖĆ ļŹöļČłņ¢┤ Ēæ£ļ®┤ ļŗ©ņ░©ņÖĆ Ēæ£ļ®┤ ļäłņÜĖņØä Ļ░Éņåīņŗ£ņ╝£ ĒÅēĒāäĒĢ£ ļÅäĻĖłņĖĄņØä ĒśĢņä▒ĒĢśļÅäļĪØ ļÅäņÖĆņŻ╝ļŖö ĒÅēĒāäņĀ£(leveler), ņĀäņ░® ņåŹļÅäļź╝ ņ¢ĄņĀ£ĒĢśļŖö ņ¢ĄņĀ£ņĀ£(inhibiter, suppressor, carrier), ĻĄ¼ļ”¼ ņĀäņ░® ņåŹļÅäļź╝ ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ░ĆņåŹņĀ£(accelerator, brightener) ļō▒ņ£╝ļĪ£ ņé¼ņÜ®ļÉśņ¢┤ ņÖöņ£╝ļéś, ļīĆļČĆļČä ĒśäņāüņĀü Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ Ļ▓ĮĒŚśņĀüņ£╝ļĪ£ ņĀüņÜ®ļÉśņŚłņ£╝ļ®░ ļÅäĻĖłņĢĪ ļé┤ņŚÉņä£ ņ£ĀļÅÖņŚÉ ņØśĒĢ£ ņ▓©Ļ░ĆņĀ£ņØś ĒØĪņ░® ļ░Å ņĀäĻĖ░ĒÖöĒĢÖņĀü ĒŖ╣ņä▒ņŚÉ ļīĆĒĢ£ Ļ│Āņ░░ņØĆ ņāüļŗ╣Ē׳ ņĀ£ĒĢ£ņĀüņØ┤ļŗż. ļśÉĒĢ£ ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ļōżņØĆ ņŗżņĀ£ ņĪ░ņŚģņĪ░Ļ▒┤Ļ│╝ļŖö ņ░©ņØ┤Ļ░Ć ņ׳ļŖö 10 ASD ņØ┤ĒĢśņØś ļé«ņØĆ ņĀłļźśļ░ĆļÅäņŚÉņä£ ņłśĒ¢ēļÉśņŚłņØä ļ┐Éļ¦ī ņĢäļŗłļØ╝, ņ¢ĄņĀ£ņĀ£ņÖĆ ĒÅēĒāäņĀ£ņÖĆņØś ņĪ░ņä▒ļ╣äņŚÉ ļīĆĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│ä ļśÉĒĢ£ ĻĘ£ļ¬ģļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļåÆņØĆ ņĀäļźśļ░ĆļÅäņŚÉņä£ ņĮ£ļØ╝Ļ▓ÉĻ│╝ JGB ņ▓©Ļ░Ćļ¤ēņŚÉ ļö░ļźĖ ņ┤łĻĖ░ ļČäĻĘ╣ĒśäņāüĻ│╝ ņØ┤ļ¤¼ĒĢ£ ļČäĻĘ╣Ēśäņāüņ£╝ļĪ£ ņØĖĒĢ£ ņĀäņ░®ņĖĄņØś Ēæ£ļ®┤ ĒŖ╣ņä▒ ļ░Å ĻĖ░Ļ│äņĀü ņä▒ņ¦łņØä ĒīīņĢģĒĢśņśĆļŗż.
2. ņŗżĒŚś ļ░®ļ▓ĢņĀäĒĢ┤ļÅÖļ░Ģ ņĀ£ņĪ░ļź╝ ņ£äĒĢśņŚ¼ ĒÖ®ņé░-ĒÖ®ņé░ĻĄ¼ļ”¼ ļÅäĻĖłņÜĢņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ļŗżņ¢æĒĢ£ ņ▓©Ļ░ĆņĀ£ ņżæ Ļ░ĆņåŹņĀ£ļĪ£ļŖö MPSA(3-mercapto-1-propane sulfonic acid)ņØä ĒÅēĒāäņĀ£ļŖö JGBļź╝ ĻĘĖļ”¼Ļ│Ā ņ¢ĄņĀ£ņĀ£ļŖö ņĮ£ļØ╝Ļ▓É(MW: 16,000~20,000)ņØä ņé¼ņÜ®ĒĢśņśĆļŗż(Ēæ£ 1). Ļ░£ļ│äņ▓©Ļ░ĆņĀ£ņŚÉ ļīĆĒĢ£ ņ▓©Ļ░Ćļ¤ē ĒģīņŖżĒŖĖļź╝ ņ¦äĒ¢ēĒĢ£ ņØ┤Ēøä ņ▓©Ļ░ĆņĀ£ļź╝ Ēś╝ĒĢ®ĒĢśņŚ¼ ĒģīņŖżĒŖĖļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ņ¢æĻĘ╣ņ£╝ļĪ£ļŖö ļČłņÜ®ņä▒ ņ¢æĻĘ╣(IrO2/Ti)ņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ņØīĻĘ╣ņ£╝ļĪ£ļŖö ĒāĆņØ┤ĒāĆļŖäĒīÉ(99.9%)ņØä #600 ~ #1500Ļ╣īņ¦Ć ņł£ņ░©ņĀüņ£╝ļĪ£ ņŚ░ļ¦łĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆļŗż. Ļ░£ļ│äņ▓©Ļ░ĆņĀ£ņØś ņ▓©Ļ░Ćļ¤ēņŚÉ ļö░ļźĖ ļČäĻĘ╣ņĀäņĢĢ ņĖĪņĀĢņØä ņ£äĒĢśņŚ¼ 1 cm2 Ēü¼ĻĖ░ņØś ņøÉĒśĢņØ┤ ļģĖņČ£ļÉśļÅäļĪØ ņØīĻĘ╣ņØä ņĀ£ņĪ░ĒĢśņśĆņ£╝ļ®░, ļ│ĄĒĢ®ņĀüņØĖ ņ▓©Ļ░ĆņĀ£ ņśüĒ¢ź ĒÅēĻ░Ćļź╝ ņ£äĒĢśņŚ¼ 50 mm ├Ś 150 mm Ēü¼ĻĖ░ņØś ĻĖ░ĒīÉņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņØīĻĘ╣Ļ│╝ ņ¢æĻĘ╣ņØś ĻĘ╣Ļ░äĻ▒░ļ”¼ļŖö 10 cmļĪ£ ņØ╝ņĀĢĒĢśĻ▓ī ņ£Āņ¦ĆĒĢśņśĆĻ│Ā ļÅäĻĖłņØ┤ ņ¦äĒ¢ēļÉśļŖö ļÅÖņĢł ļÅäĻĖłņĢĪ ņś©ļÅäļŖö 50 ┬░C(┬▒0.5 ┬░C)ļĪ£ ņ£Āņ¦ĆĒĢśņśĆļŗż. ņĀäļźśņØĖĻ░ĆļŖö ņĀĢņĀäļźś ļ¬©ļō£ ļ░®ņŗØņ£╝ļĪ£ 20 ASD(A/dm2)ļĪ£ ņ¦äĒ¢ēĒĢśņśĆņ£╝ļ®░, ļ¼╝ņä▒ļČäņäØņØä ņ£äĒĢśņŚ¼ 12 ╬╝m ļæÉĻ╗śĻ░Ć ļÉśļÅäļĪØ ņĀäņ░®ņŗ£ņ╝░ļŗż. ļÅäĻĖłņĖĄņØś Ēæ£ļ®┤ĒśĢņāü Ļ┤Ćņ░░Ļ│╝ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ļź╝ ļČäņäØĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į(FESEM, SU-70, Hitachi, Japan), XņäĀ ĒÜīņĀłļČäņäØĻĖ░(Dmax III-A type, Rigaku Co., Japan)ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ļśÉĒĢ£ ĻĖ░Ļ│äņĀü ņä▒ņ¦ł ņĖĪņĀĢņØä ņ£äĒĢśņŚ¼ IPC-TM-650 ĻĘ£Ļ▓®ņŚÉ ļ¦×Ļ▓ī ņĀäņ░®ņĖĄņØä ĒāĆņØ┤ĒāĆļŖä ĒīÉņ£╝ļĪ£ļČĆĒä░ ļČäļ”¼ĒĢśņŚ¼ 12.7 mm ├Ś 100 mm Ēü¼ĻĖ░ļĪ£ ņĀłļŗ©ĒĢśĻ│Ā, ņØĖņןņŗ£ĒŚśĻĖ░(AG-X, Shimadzu, Japan)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņØĖņןĻ░ĢļÅäņÖĆ ņŚ░ņŗĀņ£©ņØä ņĖĪņĀĢĒĢśņśĆļŗż. ņØĖņןĻ░ĢļÅä ĒģīņŖżĒŖĖļŖö 6ĒÜīļź╝ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░ ņĖĪņĀĢĻ░ÆņØĆ Minitab ĒöäļĪ£ĻĘĖļשņØä ņé¼ņÜ®ĒĢśņŚ¼ ĒåĄĻ│ä ņ▓śļ”¼ĒĢśņśĆļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░3.1 Ļ░£ļ│ä ņ▓©Ļ░ĆņĀ£ņØś ņ┤łĻĖ░ ņĀäņĢĢ
ĻĘĖļ”╝ 1ņØĆ ņ▓©Ļ░ĆņĀ£ļź╝ ņ▓©Ļ░ĆĒĢśņ¦Ć ņĢŖņØĆ ĒÖ®ņé░-ĒÖ®ņé░ĻĄ¼ļ”¼ ĻĖ░ļ│ĖņÜĢņŚÉ ņŚ╝ĒÖöņØ┤ņś©ņØä ļåŹļÅäļź╝ ļŗ¼ļ”¼ĒĢśņŚ¼ ņ┤łĻĖ░ 0.2ņ┤ł ņĀäĒĢ┤ļÅäĻĖłņØä ņ¦äĒ¢ēĒĢśļŖö ļÅÖņĢłņØś ņĀäņĢĢ ļ│ĆĒÖöļź╝ ļéśĒāĆļéĖ Ļ▓░Ļ│╝ņØ┤ļŗż. ņŚ╝ĒÖöņØ┤ņś©ņØś ņ▓©Ļ░Ćņŗ£ ņ▓©Ļ░ĆņĀ£ļź╝ Ēł¼ņŚ¼ĒĢśņ¦Ć ņĢŖņØĆ ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣ä ņĀäņĢĢņØĆ ņĀäļ░śņĀüņ£╝ļĪ£ ņāüņŖ╣ĒĢśņśĆļŗż. ņ▓©Ļ░Ć ļåŹļÅäļ│äļĪ£ļŖö ņ▓©Ļ░Ćļ¤ēņØ┤ 10 ppmņØĖ Ļ▓ĮņÜ░ņŚÉ Ļ░Ćņן ļåÆņØĆ ņĀäņĢĢņØä ļ│┤ņśĆĻ│Ā, ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ņĀäņĢĢņØ┤ Ļ░ÉņåīĒĢśņŚ¼ 40 ppm ņØ┤ņāüņØś ņĪ░Ļ▒┤ņŚÉņä£ļŖö ņ£ĀņØśņ░©Ļ░Ć ņŚåņŚłļŗż. ņŚ╝ĒÖöņØ┤ņś©ņØĆ ĻĄ¼ļ”¼ ņĀäņ░®ņĖĄ Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ĒĢśņŚ¼ ĻĄ¼ļ”¼ ņØ┤ņś©Ļ│╝ ņĀäņ░®ņĖĄ Ēæ£ļ®┤ņØś Ļ▒░ļ”¼ļź╝ ņżäņŚ¼ņŻ╝ļŖö Ļ░ĆĻĄÉ ņŚŁĒĢĀņØä ĒĢśĻĖ░ņŚÉ ņĀüņØĆ ļ¤ēņØĆ 10 ppm ņ▓©Ļ░Ćņŗ£ņŚÉļŖö Ēæ£ļ®┤ņØś ņØ╝ļČĆ ņśüņŚŁņŚÉņä£ ĻĄ¼ļ”¼ņØ┤ņś©Ļ│╝ Ļ▓░ĒĢ®ņØä ĒĢśļĀżĻ│ĀĒĢśĻĖ░ņŚÉ ņĀäņĢĢņØ┤ ņāüņŖ╣ĒĢśņśĆĻ│Ā, ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ĻĖ░ņ¦Ć Ēæ£ļ®┤ņØś ņŚ¼ļ¤¼ ņśüņŚŁņ£╝ļĪ£ ņŚ╝ĒÖöņØ┤ņś©ņØ┤ ļČäĒżļÉśņ¢┤ ĻĄ¼ļ”¼ņØ┤ņś©Ļ│╝ Ļ▓░ĒĢ®ĒĢśĻĖ░ņŚÉ ņĀäņĢĢņØ┤ ļé«ņĢäņ¦Ćļŗż 40 ppmņØ┤ņāüņØś ņĪ░Ļ▒┤ņŚÉņä£ļŖö ļŹö ņØ┤ņāü ļ│ĆĒÖöĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ĻĘĖļ”╝ 2ļŖö ņŚ╝ĒÖöņØ┤ņś©ņØś ņ▓©Ļ░Ćļ¤ēņØä ļŗ¼ļ”¼ĒĢśņŚ¼ 0.2ņ┤ł ļÅÖņĢł ļÅäĻĖłĒĢ£ Ēæ£ļ®┤ņØä Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ņØ┤ļŗż. ņĢäļ¼┤ļ¤░ ņ▓©Ļ░ĆņĀ£ļź╝ ņČöĻ░ĆĒĢśņ¦Ć ņĢŖņØĆ ļ¼┤ņ▓śļ”¼ ĻĄ░ņØś Ļ▓ĮņÜ░ 1 ╬╝m ņØ┤ĒĢśņØś ĻĄ¼ĒśĢ Ļ▓░ņĀĢļōżņØ┤ Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉśĻ│Ā ņ׳ņ£╝ļ®░, ņŚ╝ĒÖöņØ┤ņś©ļīĆļ╣ä ĻĖ░ņ¦Ć Ēæ£ļ®┤ņŚÉ ļäōĻ▓ī ļČäĒżĒĢśņŚ¼ Ļ▓░ņĀĢņØ┤ ĒśĢņä▒ļÉśĻ│Ā ņ׳ļŗż. ņŚ╝ĒÖöņØ┤ņś©ņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņĀäņ▓┤ņĀüņ£╝ļĪ£ Ļ▓░ņĀĢļōżņØ┤ ņØæņ¦æĒĢ┤ņä£ ĒśĢņä▒ļÉśļŖö Ļ▓ĮĒ¢źņØ┤ ņ׳ņ£╝ļ®░, Ēæ£ļ®┤ņŚÉ Ēü░ Ļ▓░ņĀĢņØ┤ ņĪ┤ņ×¼ĒĢśĻ│Ā ņŻ╝ļ│Ćņ£╝ļĪ£ ņ×æņØĆ Ļ▓░ņĀĢļōżņØ┤ ņāØņä▒ļÉśļŖö ĒśĢĒā£ļĪ£ Ļ▓░ņĀĢņØś Ēü¼ĻĖ░Ļ░Ć ĻĘĀņØ╝ĒĢśņ¦Ć ņĢŖļŖö ĒŖ╣ņä▒ņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ļśÉĒĢ£ Ļ▓░ņĀĢņØś Ēæ£ļ®┤ņØä ĒÖĢļīĆĒĢśņŚ¼ Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ ļ¼┤ņ▓śļ”¼ ĻĄ░ņØś Ļ▓ĮņÜ░ ĻĄ¼ļ”¼ Ļ▓░ņĀĢņØś Ēæ£ļ®┤ņØ┤ ļ¦żļüäļ¤¼ņÜ┤ ļ░śļ®┤ ņŚ╝ĒÖöņØ┤ņś©ņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö Ēü░ Ļ▓░ņĀĢ Ēæ£ļ®┤ņŚÉ ņ×æņØĆ Ļ▓░ņĀĢļōżņØ┤ ļ¦ÄņØ┤ ļČÖņ¢┤ņ׳ļŖö ĒśĢĒā£ļź╝ ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż (ĻĘĖļ”╝ 3).
MPSAņ▓©Ļ░ĆņĀ£ņØś ņ▓©Ļ░Ćļ¤ēņØä ļŗ¼ļ”¼ĒĢśņŚ¼ ņ▓©Ļ░ĆĒĢśņŚ¼ 0.2ņ┤ł ļÅäĻĖłņŗ£Ļ░äļÅÖņĢłņØś ņĀäņĢĢņØś ļ│ĆĒÖöļź╝ ĻĘĖļ”╝ 4ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. MPSAņ▓©Ļ░ĆņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ļ¼┤ņ▓©ĻĄ░ ļīĆļ╣ä ņĀäļ░śņĀüņ£╝ļĪ£ ņĀäņĢĢņØ┤ ļåÆĻ▓ī ĒśĢņä▒ļÉśņŚłĻ│Ā MPSAņ▓©Ļ░Ćļ¤ēļ│äļĪ£ ņé┤ĒÄ┤ļ│┤ļ®┤, 10 ppm ņ▓©Ļ░Ć ņŗ£ ļåÆĻ▓ī ĒśĢņä▒ļÉśļŹś ņĀäņĢĢņØ┤ ņ▓©Ļ░Ćļ¤ēņØ┤ 40 ppmĻ╣īņ¦Ć ņä£ņä£Ē׳ Ļ░ÉņåīĒĢśļŗż 60 ppmņØś Ļ▓ĮņÜ░ņŚÉļŖö 10 ppmļ│┤ļŗż ļåÆņØĆ ņĀäņĢĢņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś MPSA 60 ppmņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ļź╝ ņĀ£ņÖĖĒĢśĻ│ĀļŖö ņŚ╝ĒÖöņØ┤ņś©ņØä ņ▓©Ļ░ĆĒĢśņśĆļŹś ņĪ░Ļ▒┤ļīĆļ╣ä ļé«ņØĆ ņĀäņĢĢņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. Ēæ£ļ®┤ņØä Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ņØĖ ĻĘĖļ”╝ 5ļź╝ ļ│┤ļ®┤ ņ▓©Ļ░Ćļ¤ēņØ┤ 10 ppmļ│┤ļŗż ņ”ØĻ░ĆļÉśļ®┤ņä£ Ļ▓░ņĀĢņØ┤ ļŁēņ╣śļŖö ĒśäņāüņØä ļ│┤ņØ┤Ļ│Ā ņ׳ņ£╝ļ®░, Ēæ£ļ®┤ņŚÉņä£ ļ│äļ¬©ņ¢æņØś Ļ▓░ņĀĢļōżņØ┤ ĒśĢņä▒ļÉśĻ│Ā ņ׳ļŗż. MPSA 60 ppmņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ĻĘĖļ”╝ 4ņŚÉņä£ ņĀäņĢĢņØ┤ ņ”ØĻ░ĆĒĢ£ ņøÉņØĖņ£╝ļĪ£ļŖö Ļ▓░ņĀĢļōżņØ┤ Ēæ£ļ®┤ņŚÉ Ļ│Āļź┤Ļ▓ī ĒśĢņä▒ļÉśņ¦Ć ļ¬╗ĒĢśĻ│Ā ņØ╝ļČĆņŚÉņä£ Ļ▓░ņĀĢņØ┤ Ēü¼Ļ▓ī ņä▒ņןĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņĀäņĢĢņØ┤ ņ”ØĻ░ĆļÉ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ļśÉĒĢ£, ņŚ╝ĒÖöņØ┤ņś©Ļ│╝ MPSAļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ Ļ▓░ņĀĢņØ┤ Ēæ£ļ®┤ņŚÉ Ļ│Āļź┤Ļ▓ī ļČäĒżĒĢśļĀżļŖö Ļ▓ĮĒ¢ź ļ│┤ļŗżļŖö Ļ▓░ņĀĢĻ│╝ Ļ▓░ņĀĢņØ┤ ņä£ļĪ£ ņØæņ¦æĒĢśļĀżļŖö Ļ▓ĮĒ¢źņØ┤ Ļ░ĢĒĢ┤ņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ņ¢ĄņĀ£ņĀ£ņØĖ ņĮ£ļØ╝Ļ▓ÉņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņØś ņĀäņĢĢņØä ĻĘĖļ”╝ 6ņŚÉ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, ņĮ£ļØ╝Ļ▓ÉņØä 10 ppm ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣ä ņĀäņĢĢņØ┤ ļé«Ļ▓ī ĒśĢņä▒ņØ┤ ļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś 20 ppm ņØ┤ņāüņØś ņĪ░Ļ▒┤ņŚÉņä£ļŖö ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣ä ņĀäņĢĢņØ┤ ļåÆĻ▓ī ĒśĢņä▒ņØ┤ ļÉśņŚłĻ│Ā 30 ppmņŚÉņä£ ņĄ£ļīĆņ╣śļź╝ ļ│┤ņØ┤Ļ│Ā ņĀäņĢĢņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż. ļśÉĒĢ£ ņĮ£ļØ╝Ļ▓ÉņØä 30 ppm ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņØś ļŗżļźĖ ņ▓©Ļ░ĆņĀ£ļź╝ ņ▓©Ļ░ĆĒĢśņŚ¼ ņŗżĒŚśĒĢ£ Ļ▓░Ļ│╝ņÖĆ ļ╣äĻĄÉ ņŗ£ Ļ░Ćņן ļåÆņØĆ ņĀäņĢĢņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ Ēæ£ļ®┤ņØś ĒśĢņāüņØä ĻĘĖļ”╝ 7ņŚÉņä£ ļ╣äĻĄÉ ņŗ£ ņĮ£ļØ╝Ļ▓ÉņØś ņ▓©Ļ░Ćļ¤ē 10~20 ppm ņØĖ Ļ▓ĮņÜ░ņŚÉļŖö ĻĄ¼ĒśĢ ĒśĢĒā£ņØś Ļ▓░ņĀĢļōżņØ┤ Ēæ£ļ®┤ņŚÉ ņĪ┤ņ×¼ĒĢśļéś, 30 ppm ņØ┤ņāüņØś ņĪ░Ļ▒┤ņŚÉņä£ļŖö Ļ▓░ņĀĢļōżņØ┤ ņØæņ¦æļÉśĻ│Ā Ļ▓░ņĀĢņ£äņŚÉ Ļ▓░ņĀĢņØ┤ ņä▒ņןĒĢśņŚ¼ ļ│äļ¬©ņ¢æņØś Ļ▓░ņĀĢņØ┤ Ēæ£ļ®┤ņŚÉ ņĪ┤ņ×¼ĒĢśĻ│Ā ņ׳ļŗż. ņĮ£ļØ╝Ļ▓ÉņØ┤ ĻĖ░ņ¦Ć Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉśņ¢┤ ĻĄ¼ļ”¼ ņØ┤ņś©ņØś ņØ┤ļÅÖņØä ņøÉĒÖ£ĒĢśņ¦Ć ļ¬╗ĒĢśĻ▓ī ĒĢśņŚ¼ Ļ▓░ņĀĢņ£äņŚÉ ļśÉ ļŗżļźĖ Ļ▓░ņĀĢļōżņØ┤ ņāØņä▒, ņä▒ņןĒĢśļŖö ĒśĢņāüņØä ļ│┤ņØ┤Ļ│Ā ņ׳ņ£╝ļ®░, ĻĄ¼ļ”¼ņØ┤ņś©ņØś ņØ┤ļÅÖņØä ņøÉĒÖ£ĒĢśņ¦Ć ļ¬╗ĒĢśĻ▓ī ĒĢśļŖö ņ×æņÜ®ņ£╝ļĪ£ ĻĘĖļ”╝ 6ņŚÉņä£ ļåÆņØĆ ņĀäņĢĢņØä ļéśĒāĆļéśĻ▓ī ĒĢśļŖö ņøÉņØĖņ£╝ļĪ£ ĒīīņĢģļÉ£ļŗż.
ĒÅēĒāäņĀ£ņØĖ JGB ņ▓©Ļ░ĆņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ ļÅäĻĖłņÜĢņŚÉņä£ ļÅäĻĖłņØä ņ¦äĒ¢ēĒĢśļŖö ļÅÖņĢłņØś ņĀäņĢĢņØä ĻĘĖļ”╝ 8ņŚÉ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, JGB ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ņĀäņĢĢņØ┤ ņāüņŖ╣ĒĢśļŗż 30 ppmņØĖ ņĪ░Ļ▒┤ņŚÉņä£ Ļ░Ćņן ļåÆņØĆ ņĀäņĢĢņØä ļ│┤ņØ┤Ļ│Ā ņ׳ņ£╝ļ®░, ņØ┤Ēøä ņĀäņĢĢņØ┤ Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ņĢ×ņä£ ļŗżļźĖ ņ▓©Ļ░ĆņĀ£ņŚÉņä£ļÅä ņĢī ņłś ņ׳ļō»ņØ┤ ņĀäņĢĢņØ┤ ļåÆņØĆ Ļ▓ĮņÜ░ Ļ▓░ņĀĢļōżņØ┤ ņØæņ¦æĒĢśļŖö ĒśäņāüņØä ļ│┤ņØ┤Ļ│Ā ņ׳Ļ│Ā, JGB ņ▓©Ļ░ĆņĀ£ņØś Ļ▓ĮņÜ░ņŚÉļŖö ņĀäņĢĢņØ┤ Ļ░Ćņן ļåÆņØĆ ņĪ░Ļ▒┤(30 ppm)ņŚÉņä£ Ļ▓░ņĀĢļōżņØ┤ ņØæņ¦æļÉśļŖö ĒśäņāüņØä Ļ┤Ćņ░░ ĒĢĀ ņłś ņ׳ļŗż(ĻĘĖļ”╝ 9). ļśÉĒĢ£ Ēü░ Ļ▓░ņĀĢņØś Ēæ£ļ®┤ņŚÉņä£ ļŗżņłśņØś ļ»ĖņäĖ Ļ▓░ņĀĢļōżņØ┤ ņāØņä▒ļÉśĻ│Ā ņä▒ņןņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż. Ļ░£ļ│äņĀüņ£╝ļĪ£ ņ▓©Ļ░ĆņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ņ▓©Ļ░ĆņĀ£ ņóģļźśļ│ä ņ┤łĻĖ░ ņĀäņĢĢ ņ░©ņØ┤Ļ░Ć ņ׳ņ£╝ļ®░, ņ▓©Ļ░ĆņĀ£ļ│ä ņĄ£ļīĆ ņĀäņĢĢņŚÉ ļÅäļŗ¼ĒĢśļŖö ņ▓©Ļ░Ćļ¤ēņŚÉļÅä ņ░©ņØ┤ļź╝ ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś Ēæ£ļ®┤ņØ┤ ĻĘĀņØ╝ĒĢ£ ļÅäĻĖłņĖĄņØä ņ¢╗ĻĖ░ ņ£äĒĢ┤ņä£ļŖö Ļ░£ļ│ä ņ▓©Ļ░ĆņĀ£ļ¦īņ£╝ļĪ£ļŖö ņĀ£ņĪ░Ļ░Ć ņ¢┤ļĀĄĻĖ░ņŚÉ ņØ┤ļ¤¼ĒĢ£ ņ▓©Ļ░ĆņĀ£ņØś Ēś╝ĒĢ®ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņČöĻ░ĆņĀüņ£╝ļĪ£ ĒĢäņÜöĒĢśļŗż.
Ļ░£ļ│äņ▓©Ļ░ĆņĀ£ ĒģīņŖżĒŖĖ Ļ▓░Ļ│╝ņŚÉņä£ ņŚ╝ĒÖöņØ┤ņś©ņØĆ ņ▓©Ļ░Ćļ¤ēņŚÉ ļö░ļØ╝ ņĀäņĢĢņØ┤ ļ│ĆĒÖöĻ░Ć ņĀüņØĆ 40 ppmņØä ņäĀņĀĢĒĢśņśĆĻ│Ā, Ļ░ĆņåŹņĀ£ņØĖ MPSAņØś Ļ▓ĮņÜ░ ļÅäĻĖłņØ┤ ņ¦äĒ¢ēļÉśļ®┤ņä£ ļČäĒĢ┤Ļ░Ć ļÉśĻĖ░ņŚÉ ņĀäņĢĢ ļ│ĆĒÖöĻ░Ć ņĀüņØĆ 40 ppmņØä ņ¢ĄņĀ£ņĀ£ņØĖ ņĮ£ļØ╝Ļ▓ÉņØś Ļ▓ĮņÜ░ņŚÉļŖö ņĀäņĢĢ ņāüņŖ╣ĒÅŁņØ┤ ĻĖēĻ▓®Ē׳ ļ│ĆĒÖöĒĢśņśĆļŹś 20 ppm, 30 ppmņØä ņäĀņĀĢĒĢśņśĆļŗż. ļśÉĒĢ£ ĒÅēĒāäņĀ£ņØĖ JGBņØĆ ņØæņ¦æĒśäņāüņØ┤ ļŗżņåī ņĀüņØĆ 10 ppmņØä ņäĀņĀĢĒĢśņśĆļŗż. Ēæ£ 2ļŖö ļ│ĄĒĢ®ņ▓©Ļ░ĆņĀ£ņØś ņĪ░Ļ▒┤Ļ│╝ 0.2ņ┤łĻ░ä ļÅäĻĖłņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö Ļ│╝ņĀĢņŚÉņä£ņØś ņĀäņĢĢņØä ļéśĒāĆļéĖ Ļ▓āņØ┤ļŗż.
Ēæ£ 2ņŚÉņä£ņØś ņ┤łĻĖ░ ņĀäņĢĢņØĆ(0.07~0.12ņ┤ł ĻĄ¼Ļ░äņØś ņĀäņĢĢ ĒÅēĻĘĀ) ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣ä ņŚ╝ĒÖöņØ┤ņś©Ļ│╝ Ļ░ĆņåŹņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ (b)ĻĄ░ņØś Ļ▓ĮņÜ░ ņĀäņĢĢņØ┤ ņĢĮ 11 % ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, ņŚ¼ĻĖ░ņŚÉ ņČöĻ░ĆļĪ£ ņ¢ĄņĀ£ņĀ£ņØĖ ņĮ£ļØ╝Ļ▓ÉņØä 20 ppm ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņĀäņĢĢ ļ│ĆĒÖöĻ░Ć ļ»Ėļ»ĖĒĢśņśĆņ£╝ļéś 30 ppmņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ļ¼┤ņ▓©Ļ░Ć ļīĆļ╣ä ņĢĮ 17% ņ”ØĻ░ĆļĪ£ ņ”ØĻ░ĆĒÅŁņØ┤ ļ¦żņÜ░ Ēü¼Ļ▓ī ļéśĒāĆļéśĻ│Ā ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņĀäņĢĢ ņāüņŖ╣ ĒÜ©Ļ│╝ļŖö ĒÅēĒāäņĀ£ņØĖ JGB ņ▓©Ļ░ĆņĀ£ļź╝ 10 ppm ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉ ņĄ£ļīĆņ╣śļĪ£ ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣ä ņĢĮ 21% ņĀäņĢĢ ņāüņŖ╣ņØ┤ ļéśĒāĆļé¼ļŗż. ĻĘĖļ”╝ 10ņØĆ 0.2ņ┤łĻ░ä ļÅäĻĖłĒĢ£ Ēæ£ļ®┤ņØś Ļ▓░ņĀĢ ĒśĢņāüņØä Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ņØ┤ļŗż. ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣ä ņŚ╝ĒÖöņØ┤ņś©Ļ│╝ MPSAļź╝ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ Ļ▓░ņĀĢ Ēü¼ĻĖ░Ļ░Ć ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░ 1 ╬╝m ņØ┤ņāüņØś Ļ▓░ņĀĢĻ│╝ 2 ╬╝m ņØ┤ņāüņØś Ļ▓░ņĀĢņØ┤ Ēæ£ļ®┤ņŚÉ ļČäĒżĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņ¢ĄņĀ£ņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ (c), (d)ņŚÉņä£ Ļ▓░ņĀĢņØ┤ Ēü¼ĻĖ░Ļ░Ć Ļ░ÉņåīĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░ņĀĢņØś Ēü¼ĻĖ░ Ļ░ÉņåīļŖö ĒÅēĒāäņĀ£ JGBļź╝ ņ▓©Ļ░ĆĒĢ£ (e), (f)ĻĄ░ņŚÉņä£ļÅä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņ┤łĻĖ░ņØś Ļ▓░ņĀĢļ”ĮņØś Ļ░ÉņåīļŖö Ē¢źĒøä ļ¼╝ņä▒ņŚÉņä£ ņśüĒ¢źņØ┤ ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
12 ╬╝m ļæÉĻ╗śņØś ļÅäĻĖł Ēæ£ļ®┤ņĖĄņØś ĒśĢņāüņØä Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 11ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ņ┤łĻĖ░ ĒĢĄņāØņä▒Ļ│╝ņĀĢņŚÉņä£ ļ│┤ļ®┤ Ēæ£ļ®┤ņŚÉ Ļ▓░ņĀĢņØś Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ▓ī ņĪ┤ņ×¼ĒĢśņśĆļŹś (b)ĻĄ░ņŚÉņä£ Ēæ£ļ®┤ņŚÉ 1 ╬╝m ņØ┤ņāüņØś Ēü░ Ļ▓░ņĀĢļōżņØ┤ ņĪ┤ņ×¼ĒĢśņśĆĻ│Ā, ļ¼┤ņ▓©Ļ░ĆĻĄ░ (a)ņĪ░Ļ▒┤ņŚÉņä£ļŖö Ēæ£ļ®┤ņŚÉ (b)ņĪ░Ļ▒┤ļ│┤ļŗżļŖö ņ×æņ£╝ļéś ņĀĆļ░░ņ£©(1,000ļ░░)ņŚÉņä£ļÅä Ļ┤Ćņ░░ņØ┤ ļÉĀ ņĀĢļÅäņØś Ļ▓░ņĀĢņØ┤ Ēæ£ļ®┤ņŚÉ ņĪ┤ņ×¼ĒĢ©ņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłļŗż. ņ¢ĄņĀ£ņĀ£ļź╝ ņČöĻ░ĆĒĢ£ (c), (d)ĻĄ░ņŚÉņä£ļŖö Ēæ£ļ®┤ņØś Ļ▓░ņĀĢņØ┤ ĒÖĢņØĖļÉśņ¦ĆļŖö ņĢŖņĢśņ£╝ļéś, Ēæ£ļ®┤ņØ┤ ĒÅēĒāäĒĢśņ¦Ć ņĢŖĻ│Ā Ļ│©ņØ┤ ņĪ┤ņ×¼ĒĢśņśĆļŗż. ĒÅēĒāäņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ņØ┤ļ¤¼ĒĢ£ Ļ│©ņØĆ ņżäņ¢┤ļōżĻ│Ā ĒÅēĒāäĒĢ£ ļÅäĻĖł ņĖĄņØä ņ¢╗ņØä ņłś ņ׳ņŚłļŗż. ļö░ļØ╝ņä£ ĒÅēĒāäĒĢ£ ļÅäĻĖłņØä ņ¢╗Ļ│Āņ×É ĒĢ£ļŗżļ®┤ ĒÅēĒāäņĀ£ ņ▓©Ļ░ĆĻ░Ć ĒĢäņÜöĒĢ©ņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ēæ£ļ®┤ņĖĄņØś ĒśĢņāüĻ│╝ Ļ▓░ņĀĢļ”ĮņØś Ēü¼ĻĖ░ļŖö ĻĖ░Ļ│äņĀü ņä▒ņ¦łņŚÉļÅä ņśüĒ¢źņØä ļ»Ėņ╣Ā Ļ▓āņØ┤ļŗż.
Ļ▓░ņĀĢņØś Ēü¼ĻĖ░ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ XRDļČäņäØ ņןļ╣äļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĖĪņĀĢĒĢ£ Ļ▓░Ļ│╝ļź╝ ScherrerņŗØņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖö ņŗØ (1)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ļź╝ ĻĄ¼ĒĢśņśĆĻ│Ā [31,32], ņØ┤ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 12ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ņŚ¼ĻĖ░ņä£ ╬╗ļŖö XRD ņןļ╣äņØś ĻĄ¼ļ”¼ ĒāĆĻ▓¤ Ēīīņן 0.154056 nm, BļŖö ņŗ£ĒÄĖņŚÉņä£ Ļ░üĻ░ü ņĖĪņĀĢĒĢ£ ļ░śĻ░ĆĒÅŁ, ╬ĖļŖö ĒÜīņĀłĒö╝Ēü¼ņØś ņ£äņ╣śņØś 2╬ĖņØś ļ░śņĀłņØĖ Ļ░ÆņØ┤ļŗż.
ņ▓©Ļ░ĆņĀ£ļź╝ ņ▓©Ļ░ĆĒĢśņ¦Ć ņĢŖņØĆ (a)ĻĄ░ ļīĆļ╣ä Ļ░ĆņåŹņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░Ļ░Ć ļ░®ņ£äļ│ä 10.8~40.0% ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ņ¢ĄņĀ£ņĀ£ļź╝ 20 ppm ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ Ļ▓░ņĀĢļ░®ņ£äļ│ä Ļ░Ćņן Ēü░ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ļź╝ ļ│┤ņØ┤Ļ│Ā ņ׳ņ£╝ļ®░, ļ¼┤ņ▓©Ļ░Ć (a)ĻĄ░ ļīĆļ╣ä (111)ļ░®ņ£äļŖö 8.5%, (311)ļ░®ņ£äļŖö 172% Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ ņ”ØĻ░ĆĻ░Ć ņ׳ņŚłļŗż. ņśżĒ׳ļĀż ņ¢ĄņĀ£ņĀ£ 30 ppmņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ 20 ppmņØä ņ▓©Ļ░ĆĒĢ£ (c)ņĪ░Ļ▒┤ļ│┤ļŗż Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░Ļ░Ć Ļ░ÉņåīĒĢśņśĆļŗż. ĒÅēĒāäņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņØ┤ļ¤¼ĒĢ£ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ▓ī Ļ░ÉņåīĒĢśņŚ¼ ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣ä Ļ▓░ņĀĢļ░®ņ£äļ│ä 13.5~39.8%Ļ░Ć Ļ░ÉņåīĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ĒśäņāüņØĆ ĒÅēĒāäņĀ£ļŖö ņ¢ĄņĀ£ņĀ£ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ļÅäĻĖłņØä ņ¢ĄņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ ļÅäĻĖł Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ĒĢśĻ▓ī ļÉśĻ│Ā, ĒÅēĒāäņĀ£ņØś ĒØĪņ░®ļŖźļĀźņØ┤ ņ¢ĄņĀ£ņĀ£, ņ┤ēņ¦äņĀ£ļ│┤ļŗż Ļ░ĢĒĢśĻĖ░ņŚÉ ļÅäĻĖłņĖĄņØś ņä▒ņןņØä ņ¢ĄņĀ£ĒĢśņŚ¼ Ļ▓░ņĀĢļ”ĮņØś Ēü¼ĻĖ░ļź╝ Ļ░Éņåīņŗ£Ēé©ļŗż [11,27-30]. ļśÉĒĢ£ Ļ▓░ņĀĢļ”ĮņØś Ēü¼ĻĖ░ ļ│ĆĒÖöļŖö ĻĖ░Ļ│äņĀü ņä▒ņ¦łņŚÉļÅä ņśüĒ¢źņØä ļ»Ėņ╣śĻĖ░ņŚÉ ņØ┤ļ¤¼ĒĢ£ ĒŖ╣ņä▒ņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 13ņŚÉ ļéśĒāĆļé┤ņŚłļŗż.
ņ¢ĄņĀ£ņĀ£ļź╝ ņČöĻ░ĆĒĢśņŚ¼ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░Ļ░Ć ņ”ØĻ░ĆĒĢśņśĆļŹś (c), (d)ĻĄ░ņŚÉņä£ ņØĖņןĻ░ĢļÅäĻ░Ć Ļ░Ćņן ļé«Ļ│Ā ņŚ░ņŗĀņ£©ņØĆ ļåÆĻ▓ī ļéśņÖöļŗż. ņ¢ĄņĀ£ņĀ£ņ▓©Ļ░Ćļ¤ēņŚÉ ņØśĒĢ£ ņśüĒ¢źņØĆ p-value Ļ░ÆņØ┤ 0.059ļĪ£ ņ£ĀņØśņ░© ņŚ¼ļČĆļź╝ ĒīÉļŗ©ĒĢśĻĖ░ņŚÉļŖö ļ¬©ĒśĖĒĢśļéś ņŚ░ņŗĀņ£©ņØś Ļ▓ĮņÜ░ņŚÉļŖö p-value Ļ░ÆņØ┤ 0.108ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ĒÅēĒāäņĀ£ļź╝ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņ▓©Ļ░ĆĒĢ£ (d), (f)ĻĄ░ņØś Ļ▓ĮņÜ░ Ļ▓░ņĀĢļ”ĮņØś Ļ░ÉņåīļĪ£ ļ¼┤ņ▓©Ļ░ĆĻĄ░ ļīĆļ╣äņłśņ╣śņāüņ£╝ļĪ£ ņØĖņןĻ░ĢļÅäĻ░Ć ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś, p-valueĻ░ÆņØĆ 0.283ņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ĻĘĖļ¤¼ļéś ņŚ░ņŗĀņ£©ņØĆ Ļ░ÉņåīĒĢ©ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż(p-value: 0.006). ļśÉĒĢ£ ņ¢ĄņĀ£ņĀ£ļź╝ ņ▓©Ļ░ĆĒĢśņśĆļŹś(c), (d)ĻĄ░Ļ│╝ ļ╣äĻĄÉņŗ£ ņØĖņןĻ░ĢļÅäļŖö 27.6~39.6% ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ņŚ░ņŗĀņ£©ņØĆ 28.7~37.5% Ļ░ÉņåīĒĢśņśĆļŗż. ļÅäĻĖłņĖĄņØś Ēīīļŗ©ļ®┤ņØä Ļ┤ĆĒĢĀĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 14ņŚÉ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, ļ¼┤ņ▓©Ļ░ĆĻĄ░Ļ│╝ Ļ░ĆņåŹņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ (b)ņĪ░Ļ▒┤ņŚÉņä£ļŖö Ļ▓░ņĀĢļ”ĮņØ┤ ņØĖņןļ░®Ē¢źņ£╝ļĪ£ ĻĖĖĻ▓ī ļ│ĆĒśĢļÉśņ¢┤ Ēīīļŗ©ļ®┤ ļČĆĻĘ╝ņØ┤ ņ¢ćņĢäņ¦ĆļŖö shear-lipĻ│╝ Ļ░ÖņØĆ ĒśĢĒā£ņØś Ēīīļŗ©ļ®┤ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļśÉĒĢ£ ņ¢ĄņĀ£ņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ (c), (d) ņĪ░Ļ▒┤ņŚÉņä£ļÅä shear-lipņØś ĒśĢņāüņØ┤ ļ│┤ņØ┤ļéś, ĒÅēĒāäņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ Ēīīļŗ©ļ®┤ņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņ┤łĻĖ░ ĒĢĄņāØņä▒ņØś ņśüĒ¢źĻ│╝ Ļ▓░ņĀĢļ”ĮņØś ņä▒ņןņŚÉ ņØśĒĢ£ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ņØś ņśüĒ¢źņ£╝ļĪ£ ĻĖ░Ļ│äņĀü ņä▒ņ¦łņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņøÉņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
4. Ļ▓░ ļĪĀļÅäĻĖł ĒśäņןņŚÉņä£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖö Ļ│ĀņĀäļźśļ░ĆļÅä ņĀäĒĢ┤ļÅäĻĖł ņĪ░Ļ▒┤ņŚÉņä£ ņ¢ĄņĀ£ņĀ£ņÖĆ ĒÅēĒāäņĀ£ ņ▓©Ļ░ĆņŚÉ ņØśĒĢ£ Ēæ£ļ®┤ĒŖ╣ņä▒, ĻĄ¼ņĪ░ņĀü ĒŖ╣ņä▒ ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņĮ£ļØ╝Ļ▓ÉĻ│╝ JGBņØś ņ¢æņØä ļ│ĆĒÖöņŗ£ņ╝£ ņ▓©Ļ░ĆĒĢ£ Ēøä ļÅäĻĖłņĖĄņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż.
1. ņŚ╝ĒÖöņØ┤ņś© ļ░Å Ļ░ĆņåŹņĀ£ņØĖ MPSAļź╝ ļŗ©ļÅģņ£╝ļĪ£ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ļ¼┤ņ▓©Ļ░Ć ņĪ░Ļ▒┤ ļīĆļ╣ä ņĀäņĢĢņØĆ ņĀäļ░śņĀüņ£╝ļĪ£ ļåÆĻ▓ī ĒśĢņä▒ ļÉśņŚłņ£╝ļ®░, 30~40 ppm ĻĄ¼Ļ░äņŚÉņä£ļŖö ņ▓©Ļ░Ćļ¤ēņŚÉ ļīĆĒĢ£ ņĀäņĢĢ ļ│ĆĒÖöĻ░Ć Ļ░ÉņåīĒĢśņśĆļŗż. ļśÉĒĢ£ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░Ć ĒĢĀņłśļĪØ Ļ▓░ņĀĢļōżņØ┤ ņØæņ¦æĒĢ┤ņä£ ĒśĢņä▒ļÉśļŖö Ļ▓ĮĒ¢źņØ┤ ņ׳ņ£╝ļ®░, Ēæ£ļ®┤ņŚÉ Ēü░ Ļ▓░ņĀĢņØ┤ ņĪ┤ņ×¼ĒĢśĻ│Ā ņŻ╝ļ│Ćņ£╝ļĪ£ ņ×æņØĆ Ļ▓░ņĀĢļōżņØ┤ ņāØņä▒ļÉśļŖö ĒśĢĒā£ļĪ£ Ļ▓░ņĀĢņØś Ēü¼ĻĖ░Ļ░Ć ĻĘĀņØ╝ĒĢśņ¦Ć ņĢŖļŖö ĒŖ╣ņä▒ņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż.
2. ņ¢ĄņĀ£ņĀ£ņØĖ ņĮ£ļØ╝Ļ▓ÉņØä 30 ppm ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņØś ļŗżļźĖ ņ▓©Ļ░ĆņĀ£ļź╝ Ļ░£ļ│ä ņ▓©Ļ░ĆĒĢśņŚ¼ ņŗżĒŚśĒĢ£ Ļ▓░Ļ│╝ņÖĆ ļ╣äĻĄÉ ņŗ£ Ļ░Ćņן ļåÆņØĆ ņĀäņĢĢņØ┤ ļéśĒāĆļé¼ņ£╝ļ®░, ĒÅēĒāäņĀ£ņØĖ JGB ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ņĀäņĢĢņØ┤ ņāüņŖ╣ĒĢśļŗż 30 ppmņØĖ ņĪ░Ļ▒┤ņŚÉņä£ Ļ░Ćņן ļåÆņØĆ ņĀäņĢĢņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż. ņĮ£ļØ╝Ļ▓É ļ░Å JGB ņ▓©Ļ░ĆņĀ£ņØś Ļ▓ĮņÜ░ņŚÉļÅä ļŗżļźĖ ņ▓©Ļ░ĆņĀ£ņÖĆ Ļ░ÖņØ┤ ņØ╝ņĀĢ ņØ┤ņāüņØś ņ▓©Ļ░Ćļ¤ēņØ┤ ņ▓©Ļ░ĆļÉśļ®┤ Ļ▓░ņĀĢļōżņØ┤ ņØæņ¦æļÉśĻ│Ā Ļ▓░ņĀĢņ£äņŚÉ Ļ▓░ņĀĢņØ┤ ņä▒ņןĒĢśņŚ¼ ļ│äļ¬©ņ¢æņØś Ļ▓░ņĀĢņØ┤ Ēæ£ļ®┤ņŚÉ ņĪ┤ņ×¼ĒĢśņśĆļŗż.
3. ņ▓©Ļ░ĆņĀ£ļź╝ Ļ░£ļ│äņĀüņ£╝ļĪ£ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ Ēæ£ļ®┤ņŚÉ ĻĘĀņØ╝ĒĢ£ ĒĢĄņāØņä▒ ļ░Å Ļ▓░ņĀĢņä▒ņןņŚÉļŖö ņ¢┤ļĀżņøĆņØ┤ ņ׳ĻĖ░ņŚÉ ļ│ĄĒĢ®ņĀüņØĖ ņ▓©Ļ░ĆņĀ£ ņ▓©Ļ░ĆĻ░Ć ĒĢäņÜöĒĢśļ®░, ļ¼┤ņ▓©Ļ░Ć ņĪ░Ļ▒┤ļīĆļ╣ä 4Ļ░Ćņ¦Ć ņ▓©Ļ░ĆņĀ£ļź╝ ļ¬©ļæÉ ņ▓©Ļ░ĆĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ ņ┤łĻĖ░ ĒĢĄņāØņä▒ ļ░Å ņä▒ņןļŗ©Ļ│äņŚÉņä£ Ēæ£ļ®┤ņŚÉ ĻĘĀņØ╝ĒĢśĻ▓ī Ļ▓░ņĀĢņØ┤ ļČäĒżļÉśņŚłĻ│Ā, 12 ╬╝m ļæÉĻ╗śņØś ļÅäĻĖłņĖĄņŚÉņä£ļÅä ĒÅēĒÖ£ĒĢ£ Ēæ£ļ®┤ņØä ņ¢╗ņØä ņłś ņ׳ņŚłļŗż.
4. ņĮ£ļØ╝Ļ▓ÉņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņĀäņ▓┤ņĀüņ£╝ļĪ£ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ļź╝ ņ”ØĻ░Ćņŗ£ĒéżļŖö ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłņ£╝ļ®░, JGBļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö Ļ▓░ņĀĢļ”ĮņØä Ļ░Éņåīņŗ£ĒéżļŖö ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░ņĀĢļ”ĮņØś Ēü¼ĻĖ░ļ│ĆĒÖöļŖö ĻĖ░Ļ│äņĀü ņä▒ņ¦łņŚÉ ņśüĒ¢źņØä ņŻ╝ņŚłļŗż. Ļ▓░ņĀĢļ”ĮņØś Ēü¼ĻĖ░Ļ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓ĮņÜ░ ņØĖņןĻ░ĢļÅäļŖö Ļ░ÉņåīĒĢśņśĆņ£╝ļéś ņŚ░ņŗĀņ£© ņ”ØĻ░Ć ņÜöņØĖņØ┤ ļÉśņŚłņ£╝ļ®░, ļ░śļīĆļĪ£ Ļ▓░ņĀĢļ”ĮņØś Ēü¼ĻĖ░Ļ░Ć Ļ░ÉņåīĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņØĖņןĻ░ĢļÅäļŖö ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś, ņŚ░ņŗĀņ£©ņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ Ļ░£ļ│äņ▓©Ļ░ĆņĀ£ņØś ņ▓©Ļ░Ćļ¤ēņŚÉ ļö░ļźĖ ņ┤łĻĖ░ņĀäņĢĢņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, Ļ░£ļ│ä ņ▓©Ļ░ĆņĀ£ļź╝ ĒåĄĒĢśņŚ¼ ĒÅēĒÖ£ĒĢ£ ļÅäĻĖłņĖĄņØä ĒśĢņä▒ĒĢśĻĖ░ņŚÉļŖö ņ¢┤ļĀżņøĆņØ┤ ņ׳ņØīņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£ ņ▓©Ļ░ĆņĀ£ņŚÉ ļö░ļØ╝ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ļź╝ ņĀ£ņ¢┤ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņĀüņĀłĒĢ£ ļ╣äņ£©ņØä ņĀüņÜ®ĒĢśņŚ¼ ņøÉĒĢśļŖö ļ¼╝ņä▒ņØä ņĀ£ņ¢┤ ĒĢĀ ņłś ņ׳ņØīņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłļŗż.
Fig.┬Ā1.Potential performance of the electrolyte at Cl- ion additive with different concentrations. 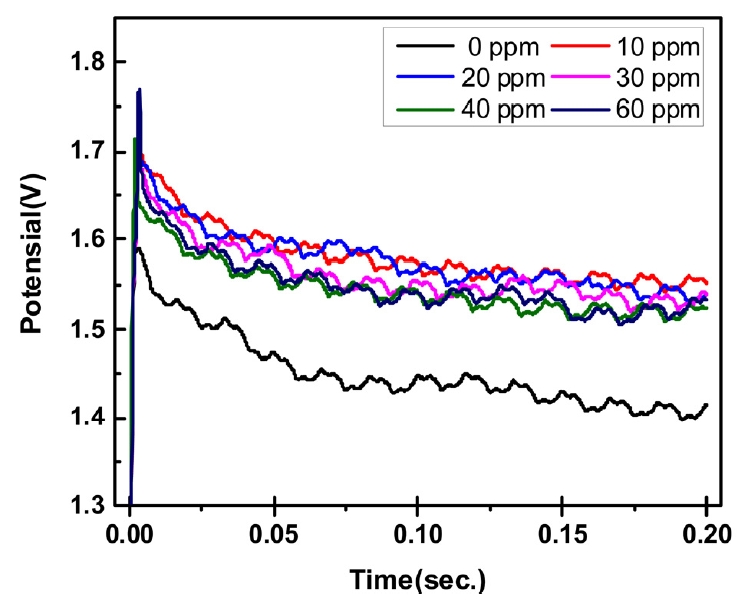
Fig.┬Ā2.SEM images of titanium surface tilted by 30 ┬░. Coppers were plated for 0.2 seconds at the addition of various Cl- ion concentrations. 
Fig.┬Ā3.SEM images of copper plating tilted by 30 ┬░. Coppers were plated for 0.2 seconds at the addition of 0 ppm (left) and 10 ppm Cl- ion (right). 
Fig.┬Ā5.SEM images of titanium surface tilted by 30 ┬░. Coppers were plated for 0.2 seconds at the addition of various MPSA concentrations. 
Fig.┬Ā6.Potential performance of the electrolyte at Collagen additive with different concentrations. 
Fig.┬Ā7.SEM images of titanium surface tilted by 30 ┬░. Coppers were plated for 0.2 seconds at the addition of various collagen concentrations. 
Fig.┬Ā9.SEM images of titanium surface tilted by 30 ┬░. Coppers were plated for 0.2 seconds at the addition of various JGB concentrations. 
Fig.┬Ā10.SEM images of titanium surface tilted by 30 ┬░. Coppers were plated for 0.2 seconds at the addition of various additives concentrations. 
Fig.┬Ā11.SEM images of copper foil tilted by 30 ┬░. Copper foils were plated for 12 ┬Ąm at the addition of various additives concentrations. 
Fig.┬Ā12.Crystallite size evolution of electroplated copper layer with additives concentrations in the solutions. 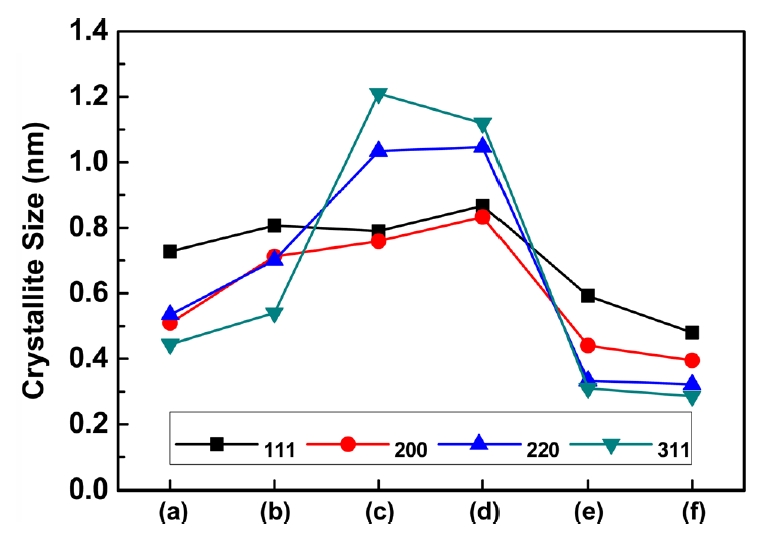
Fig.┬Ā13.Tensile strength(left) and elongation(right) of electroplated copper layer with additives concentrations in the solutions. 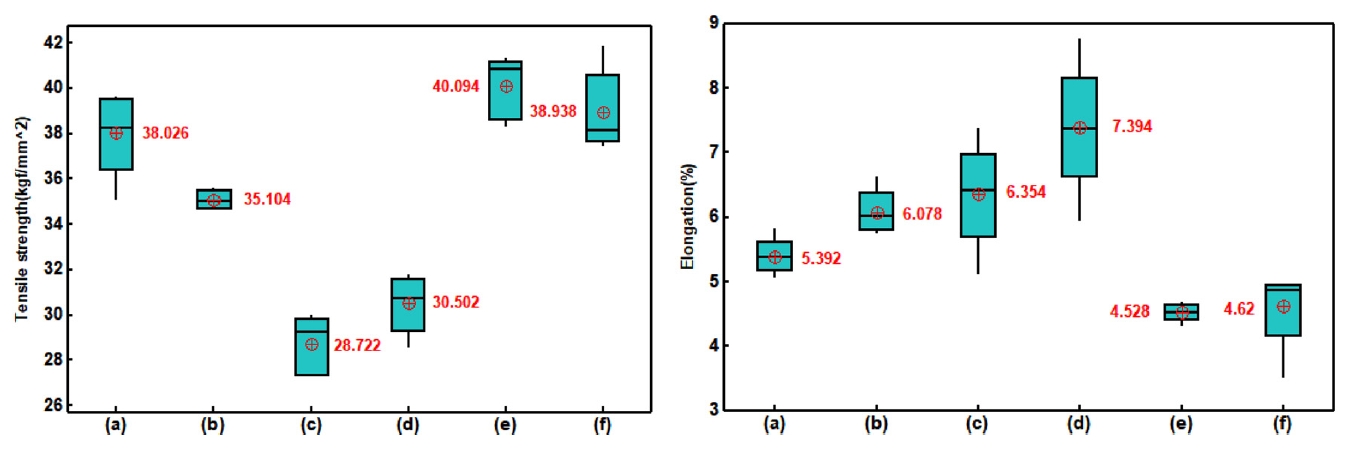
Fig.┬Ā14.Fractographs of electroplated copper layer with additives concentrations in the solutions. 
REFERENCES2. B. S. Min, W. S. Chung, and I. G. Kim, J. Kor. Inst. Met. & Mater. 40, 1281 (2002).
3. S. H. Lee and N. J. Park, J. Kor. Inst. Met. & Mater. 45, 377 (2007).
4. M. H. Kim, H. R. Cha, C. S. Choi, J. M. Kim, and D. Y. Lee, Korean. J. Met. Mater. 48, 884 (2010).
9. T. G. Woo, I. S. Park, K. H. Jung, K. S. Son, R. Song, M. H.Lee, Y. K. Hwang, and K. W. Seol, Korean J. Met. Mater. 50, 237 (2012).
10. M. H. Lee, E. K. Park, T. G. Woo, I. S. Park, Y. M. Yoon, and K. W. Seol, J. Kor. Inst. Met. & Mater. 46, 747 (2008).
14. M. L. Sartorelli, A. Q. Schervenski, R. G. Delatorre, and P. Klauss, Phys. Stat. Sol. 187, 91 (2001).
20. M. H. Kim, H. R. Cha, C. S. Choi, H. S. Kim, and D. Y. Lee, Korean J. Met. Mater. 48, 757 (2010).
21. D. J. Park, Park, Master Thesis (in Korean). 24Pusan National University, Pusan (2017).
24. Z. Nagy, J. Blaudeau, N. Hung, L. Curtiss, and D. Zurawski, J. Electrochem. Soc. 142, L87 (1995).
26. H. C. Kim, M. J. Kim, S. Choe, T. Lim, K. J. Park, K. H. Kim, S. H. Ahn, S. K. Kim, and J. J. Kim, J. Electrochem. Soc. 161, D749 (2014).
28. Q. Huang, A. Avekians, S. Ahmed, C. Parks, B. Baker-OŌĆÖNeal, S. Kitayaporn, A. Sahin, Y. Sun, and T. Cheng, J. Electrochem. Soc. 161, D388 (2014).
|
|
|||||||||||||||||||||||||||||||||||||||