1. ņä£ ļĪĀ
ņé░ņŚģņØś Ļ│ĀļÅäĒÖöņÖĆ ĒĢ©Ļ╗ś ĒÖöņäØņŚ░ļŻīņØś ņé¼ņÜ®ņØĆ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ”ØĻ░ĆļÉśĻ│Ā ņ׳ļŗż. ņØ┤ļŖö CO2 ļ░░ņČ£ļ¤ē ņ”ØĻ░ĆņŚÉ ļö░ļźĖ ņ¦ĆĻĄ¼ ņś©ļé£ĒÖöņØś ņŻ╝ ņøÉņØĖņ£╝ļĪ£ ņ¦Ćļ¬®ļÉśĻ│Ā ņ׳ļŗż[1-3]. ņØ┤ņŚÉ, ļīĆĻĖ░ ņżæņØś CO2 ļåŹļÅä Ļ░ÉņČĢņŚÉ ĒÜ©Ļ│╝ņĀüņØĖ ļ░®ņĢłņ£╝ļĪ£ņä£ CO2ļź╝ Ēżņ¦æŌłÖĒÖ£ņÜ®ŌłÖņĀĆņןĒĢśļŖö CCUS (Carbon dioxide capture utilization and storage) ĻĖ░ņłĀ Ļ░£ļ░£ņØ┤ ņĄ£ĻĘ╝ Ēü¼Ļ▓ī ņŻ╝ļ¬®ļ░øĻ│Ā ņ׳ļŗż[4-6]. ĒŖ╣Ē׳, CO2 ņłśņåĪ Ļ│╝ņĀĢ ņżæ ņłśņåĪĻ┤Ć ļé┤ļČĆņŚÉ ņĪ┤ņ×¼ĒĢśĻ▒░ļéś ņāØņä▒ļÉĀ ņłś ņ׳ļŖö ļŗżņ¢æĒĢ£ ļČłņł£ļ¼╝ (H2O, SOX, O2, H2S, NOX)ņŚÉ ņØśĒĢ£ ļČĆņŗØ ļ¼ĖņĀ£ļŖö ņłśņåĪĻ┤ĆņØś ņłśļ¬ģĻ│╝ ņĢłņĀäņä▒ņŚÉ ņ¦üņĀæņĀüņØĖ ņśüĒ¢źņØä ļü╝ņ╣śļŖö ņŻ╝ ņÜöņØĖņ£╝ļĪ£ņä£[7,8], Ļ│Āļé┤ņŗØ ņłśņåĪĻ┤Ć ņåīņ×¼ Ļ░£ļ░£ņØś ĒĢäņÜöņä▒ņØä ļČĆĻ░üņŗ£ĒéżĻ│Ā ņ׳ļŗż. ļŹöņÜ▒ņØ┤, CO2ņØś ņŻ╝ņÜö ņĀĆņן ņןņåīļĪ£ ņĢīļĀżņ¦ä ņ¦ĆĒĢś ļŗ┤ņłśņĖĄņØś Ļ▓ĮņÜ░ ļåÆņØĆ ņłśņżĆņØś ņŚ╝ĒÖöņØ┤ņś© (Cl-)ņØä ĒżĒĢ©ĒĢ£ ļČĆņŗØņä▒ ĒÖśĻ▓Į[9]ņØĖ ņĀÉņØä Ļ│ĀļĀżĒĢĀ ļĢī, CCUS ņĀüņÜ® Ļ░Ģņ×¼ņØś Ļ│Āļé┤ņŗØ ĒŖ╣ņä▒ ļ│┤ņ”ØņØĆ ĒĢäņłśņĀüņ£╝ļĪ£ ņÜöĻĄ¼ļÉśļŖö ĻĖ░ņłĀņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŗż. CO2 ņłśņåĪĻ┤ĆņØś ņåīņ×¼ļĪ£ņä£ ņŖżĒģīņØĖļ”¼ņŖż Ļ░Ģņ×¼ ļīĆļ╣ä Ļ░ĆĻ▓®Ļ▓Įņ¤üļĀźņØ┤ ņÜ░ņłśĒĢ£ ņāüņÜ® ĒāäņåīĻ░ĢņØś ņĀüņÜ®ņØ┤ Ļ│ĀļĀżļÉśĻ│Ā ņ׳ņ£╝ļ®░ ĻĘĖ ņżæ C ĒĢ©ļ¤ē ļ░Å ļČłņł£ļ¼╝ ņä▒ļČäņØ┤ ĻĘ╣Ē׳ ļé«ņØĆ ņłśņżĆņ£╝ļĪ£ ņĀ£ņ¢┤ļÉśĻ│Ā, ņĀ£ņĪ░Ļ│ĄņĀĢ ņżæ TMCP (Thermomechanical controlled process)ņŚÉ ņØśĒĢ┤ ņÜ░ņłśĒĢ£ ļ¼╝ņä▒ ĻĄ¼ĒśäņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņ¦ä APIĻĖē ļØ╝ņØĖĒīīņØ┤Ēöä Ļ░Ģņ×¼ņØś ņĀüņÜ®ŌłÖņĀüĒĢ®ņä▒ ņĖĪļ®┤ņŚÉņä£ņØś ņŚ░ĻĄ¼Ļ░Ć ņŻ╝ļ¬®ļ░øĻ│Ā ņ׳ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£, CO2Ļ░Ć ņÜ®ĒĢ┤ļÉ£ ņłśņÜ®ņĢĪņä▒ ĒÖśĻ▓ĮņŚÉļŖö ņŗØ (1)ņØä ĒåĄĒĢ£ H2CO3ņØś ĒśĢņä▒Ļ│╝ ņŗØ (2)ņÖĆ(3)ņØä ĒåĄĒĢ£ ņØ┤ņś© ĒĢ┤ļ”¼Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ pHĻ░Ć Ļ░ÉņåīļÉśļ®░, ņØ┤ Ļ▓ĮņÜ░ Ļ░Ģņ×¼ņØś ļģĖņČ£ņØĆ Ļ░Ģņ×¼/ņÜ®ņĢĪ Ļ│äļ®┤ņŚÉņä£ ļ╣ĀļźĖ ņ¢æĻĘ╣ņÜ®ĒĢ┤ļ░śņØæ (ņŗØ (4))Ļ│╝ ņłśņåīĒÖśņøÉļ░śņØæ (ņŗØ (5))ņØ┤ ņ£ĀļÅäļÉ£ļŗż[10].
ļśÉĒĢ£, Ļ░Ģņ×¼ Ēæ£ļ®┤ņŚÉļŖö ļČĆņŗØņāØņä▒ļ¼╝ (FeCO3)ņØ┤ ĒśĢņä▒ļÉĀ ņłś ņ׳ļŖöļŹ░, ļŗżņ¢æĒĢ£ ĒÖśĻ▓ĮņØĖņ×É (ņś©ļÅä, CO2 ļČäņĢĢ, pH, O2 ļåŹļÅä ļō▒)ņŚÉ ņØśĒĢ┤ ņāØņä▒ļ¼╝ņØś ĒŖ╣ņä▒ņØ┤ Ēü¼Ļ▓ī ņóīņÜ░ļÉśļ®░ ņČöĻ░ĆņĀüņØĖ ļČĆņŗØ ļ░śņØæ ņåŹļÅäņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[11-13]. ņåīņ×¼Ļ░£ļ░£ ņĖĪļ®┤ņŚÉņä£ļŖö ņŻ╝ņ¢┤ņ¦ä ĒÖśĻ▓ĮņĪ░Ļ▒┤ ļé┤ Ļ░Ģņ×¼ņØś ļé┤ņŗØņä▒ Ē¢źņāüņØä ņ£äĒĢ£ ĒÜ©ņ£©ņĀü ĒĢ®ĻĖłņäżĻ│äĻ░Ć ņØ╝ņ░©ņĀüņØĖ ļ¬®Ēæ£Ļ░Ć ļÉĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ņŚÉ ļīĆļץ 2 ~ 3 wt% ņłśņżĆņØś Cr ņ▓©Ļ░Ć[14,15]ņÖĆ 0.3 ~ 1 wt% ņłśņżĆņØś Mo ņ▓©Ļ░Ć[16] ļ░Å < 1 wt% Cr, <0.3 wt% MoņØś ļ»Ėļ¤ē ņ▓©Ļ░Ć[17]ļź╝ ĒåĄĒĢ£ CO2 ļé┤ņŗØņä▒ Ē¢źņāü ĒÜ©Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉśĻĖ░ļÅä ĒĢśņśĆļŗż. ĒĢśņ¦Ćļ¦ī, ĒĢ®ĻĖłņä▒ļČäņŚÉ ļö░ļźĖ ļČĆņŗØ ņĀĆĒĢŁņä▒ ĻĄ¼Ēśä ļ®öņ╗żļŗłņ”śņØ┤ Ļ░üĻ░ü ņāüņØ┤ĒĢ£ ļČĆļČäņØ┤ ņĪ┤ņ×¼ĒĢśļ®░ ņĄ£ņĀü ĒĢ®ĻĖłņäżĻ│äņŚÉ ņ׳ņ¢┤ ņ¢┤ļĀżņøĆņØĆ ņ¦ĆņåŹļÉśĻ│Ā ņ׳ļŗż. ņØ┤ņŚÉ, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ│┤ļŗż Ļ▓ĮņĀ£ņĀüņØĖ ņĖĪļ®┤ņŚÉņä£ ĻĘ╣ļ»Ėļ¤ēņØś ņä▒ļČäņĀ£ņ¢┤ (Cr: 0.4 ~ 0.5 wt%; Mo: 0.1 ~ 0.15 wt%)ņØś ĒÜ©Ļ│╝ļź╝ ņŗżĒŚśņĀüņ£╝ļĪ£ ņÜ░ņäĀ Ļ▓Ćņ”ØĒĢśĻ│Ā ļ®öņ╗żļŗłņ”śņĀü ļģ╝ņØśļź╝ ļ░öĒāĢņ£╝ļĪ£ CO2 ļé┤ņŗØĻ░Ģ Ļ░£ļ░£ņØä ņ£äĒĢ£ ņČöĻ░ĆņĀüņØĖ ĒĢ®ĻĖłņäżĻ│äņØś ļ░®Ē¢źņØä ņĀ£ņŗ£ĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
2. ņŗżĒŚśļ░®ļ▓Ģ
2.1 ņŗ£ĒÄĖņĀ£ņĪ░ ņĀĢļ│┤ ļ░Å ļ»ĖņäĖņĪ░ņ¦ü ļČäņäØ
ļ│Ė ņŚ░ĻĄ¼ņØś ļīĆņāü ņŗ£ĒÄĖņØĆ API X65ĻĖē Ļ░Ģņ×¼ņŚÉ ĒĢ┤ļŗ╣ļÉśļ®░, ĻĘ╣Ē׳ ļ»Ėļ¤ēņØś Cr (0.4 ~ 0.5 wt%) ļ░Å Mo (0.1 ~ 0.15 wt%)ņØś ņ▓©Ļ░Ć ņ£Āļ¼┤ņŚÉ ļö░ļØ╝ ļ¼┤ ņ▓©Ļ░Ćņ×¼ņØĖ X65, Mo ļŗ©ļÅģ ņ▓©Ļ░Ćņ×¼ņŚÉ ĒĢ┤ļŗ╣ļÉśļŖö X65 (Mo), CrĻ│╝ MoņØś ļ│ĄĒĢ®ņ▓©Ļ░Ćņ×¼ņØĖ X65 (Cr,Mo)ļĪ£ ĻĄ¼ļČäļÉ£ļŗż.
Ēæ£ 1ņŚÉ ņäĖ ņŗ£ĒÄĖņØś ĒÖöĒĢÖņĀüņĪ░ņä▒ņØä ļéśĒāĆļé┤ņŚłņ£╝ļ®░, JMatPro software (Sente software)ļź╝ ĒÖ£ņÜ®ĒĢśņŚ¼ ĒāäĒÖöļ¼╝ņØś ņäØņČ£ ņāü, ņś©ļÅä ļ░Å ļČäņ£©ņØä ņśłņĖĪĒĢśņśĆļŗż. On-line TMCP Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņĄ£ņóģ ņĢĢņŚ░ļæÉĻ╗ś 10mmļĪ£ ņĀ£ņĪ░ļÉśņŚłļŗż. ņŗ£ĒÄĖņØś ļ»ĖņäĖņĪ░ņ¦ü ļČäņäØņØä ņ£äĒĢ┤ Ļ░ü ņŗ£ĒÄĖ (15├Ś15├Ś5 mm3)ņØä ļ¦łņÜ┤Ēīģ ĒĢ£ Ēøä SiC paper #2400Ļ╣īņ¦Ć ĻĖ░Ļ│äņĀü ņŚ░ļ¦ł ļ░Å 1 ╬╝mĻ╣īņ¦Ć ļ»ĖņäĖņŚ░ļ¦łļź╝ ņłśĒ¢ēĒĢśņśĆļŗż. ņØ┤Ēøä, 3% Nital (3 mL NHO3 + 97 mL Ethanol) ņÜ®ņĢĪņŚÉņä£ 8~10ņ┤ł Ļ░ä ĒÖöĒĢÖņĀü ņŚÉņ╣Ł Ēøä ņĀäĻ│ä ļ░®ņé¼ĒśĢ ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į (Field emission scanning electron microscopy, FE-SEM) ļ░Å Ēøäļ░® ņé░ļ×Ć ņĀäņ×É ĒÜīņĀłļČäņäØĻĖ░ (Electron backscatter diffraction, EBSD)Ļ░Ć ĒÖ£ņÜ®ļÉśņŚłļŗż.
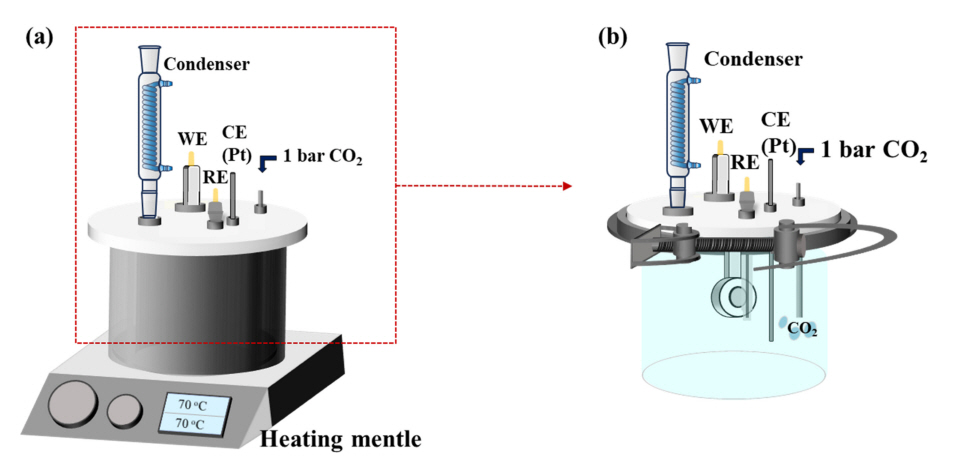
2.2 ņĀäĻĖ░ĒÖöĒĢÖņĀü ļČäĻĘ╣Ļ▒░ļÅÖ ļČäņäØ
ĻĘĖļ”╝ 1ņØĆ CO2 ĒÖśĻ▓Į ļé┤ ņĀäĻĖ░ĒÖöĒĢÖņĀü ļČĆņŗØņŗżĒŚś ņłśĒ¢ēņØä ņ£äĒĢ┤ ņĀ£ņ×æļÉ£ ņĀäĻĖ░ĒÖöĒĢÖ ņģĆņØś ļ¬©ņŗØļÅäņØ┤ļŗż. 1% NaCl + 1 g/L NaHCO3 + 1 bar CO2 (pH 6.0) ņłśņÜ®ņĢĪ ļé┤ņŚÉņä£ ņĀäĻĖ░ĒÖöĒĢÖ ņŗżĒŚś ņłśĒ¢ē ņĀä, ņÜ®ņĪ┤ņé░ņåī ņĀ£Ļ▒░ļź╝ ņ£äĒĢ┤ ļ”¼Ēä░ļŗ╣ 30ļČä ļÅÖņĢł 1 barņØś Ar purging Ēøä ļ”¼Ēä░ļŗ╣ 1ņŗ£Ļ░ä ļÅÖņĢł 1 barņØś CO2 Ļ░ĆņŖżļź╝ ņ£Āņ×ģņŗ£Ēéżļ®░ 70 ┬░CņØś ņś©ļÅäļĪ£ ņ£Āņ¦Ćņŗ£ņ╝░ļŗż. ņĀäĻĖ░ĒÖöĒĢÖ ņŗżĒŚśņØĆ ņ×æņŚģņĀäĻĘ╣ (Working electrode, WE), ņāüļīĆņĀäĻĘ╣ (Counter electrode, CE) ļ░Å ĻĖ░ņżĆņĀäĻĘ╣ (Reference electrode, RE)ņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ 3ņĀäĻĘ╣ ĒĢśņŚÉņä£ ņłśĒ¢ēļÉśņŚłņ£╝ļ®░, ĻĖ░ņżĆņĀäĻĘ╣Ļ│╝ ņāüļīĆņĀäĻĘ╣ņØĆ Ļ░üĻ░ü ņØĆ-ņŚ╝ĒÖöņØĆ ņĀäĻĘ╣(Silver/Silverchloride electrode, SSE)Ļ│╝ Pt ņĀäĻĘ╣ņØ┤ ņé¼ņÜ®ļÉśņŚłļŗż. ņĀäĻĖ░ĒÖöĒĢÖ ņŗżĒŚśņØä ņ£äĒĢ┤ Ļ░ü ņŗ£ĒÄĖ(10ŽĆ mm2)ņØä SiC paper #1200 Ļ╣īņ¦Ć ņŚ░ļ¦łļź╝ ņłśĒ¢ēĒĢśņśĆļŗż. ņĀĢņĀäņ£ä ļČäĻĘ╣ ņŗżĒŚśņØĆ ņŗ£ĒÄĖņØś Ļ░£ļ░®ĒÜīļĪ£ņĀäņ£ä (Open circuit potential, OCP) ļīĆļ╣ä 50 mVņØś ņØ╝ņĀĢĒĢ£ ņ¢æĻĘ╣ņĀäņ£äļź╝ 1ņŗ£Ļ░ä ļÅÖņĢł ņØĖĻ░ĆĒĢśļ®░ ņĀäļźśļ░ĆļÅäņØś ļ│ĆĒÖöļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņ×äĒö╝ļŹśņŖż ņŗżĒŚśņØś Ļ▓ĮņÜ░ ņŗ£ĒÄĖņØä ņÜ®ņĢĪ ļé┤ 3, 7, 14ņØ╝ ļÅÖņĢł ņ╣©ņ¦Ć Ēøä OCP ļīĆļ╣ä ┬▒10 mVņØś ņĀäņ£äļź╝ ĻĄÉļźś ļ░®ņŗØņ£╝ļĪ£ ņØĖĻ░ĆĒĢśĻ│Ā 100,000 ~ 0.01 HzņØś ņŻ╝Ēīīņłś ļ▓öņ£äņŚÉņä£ ņĖĪņĀĢļÉśļŖö ļČäĻĘ╣ ņĀĆĒĢŁ (Polarization resistance, Rp)ņØä ļ╣äĻĄÉĒĢśĻ│Āņ×É ĒĢśņśĆĻ│Ā, Nyquist plotņØä ļō▒Ļ░ĆĒÜīļĪ£ļź╝ ĻĖ░ļ░śņ£╝ļĪ£ Fitting ĒĢśņŚ¼ ņÜ®ņĢĪ ņĀĆĒĢŁ(Rs), ļČĆņŗØņāØņä▒ļ¼╝ņØś ņ╗żĒī©ņŗ£Ēä░ (Qf), ļČĆņŗØņä▒ņāØļ¼╝ņØś ņĀĆĒĢŁ (Rf), ļČĆņŗØņāØņä▒ļ¼╝Ļ│╝ ņåīņ¦Ćņ▓Ā Ļ│äļ®┤ņØś ņ╗żĒī©ņŗ£Ēä░ (Qdl), ļČĆņŗØņāØņä▒ļ¼╝Ļ│╝ ņåīņ¦Ćņ▓Ā Ļ│äļ®┤ņØś ņĀäĒĢśņĀäļŗ¼ ņĀĆĒĢŁ (Rct)ņØä ļÅäņČ£ĒĢśņśĆļŗż. ņäĀĒśĢļČäĻĘ╣ņĀĆĒĢŁ (Linear polarization resistance, LPR) ņŗżĒŚśņØĆ ņ×äĒö╝ļŹśņŖżņÖĆ ļÅÖņØ╝ĒĢ£ ņŗ£Ļ░ä ļÅÖņĢł ņ╣©ņ¦Ć Ēøä OCP ĻĖ░ņżĆ -20mV ~ 20mV ņĀäņ£äĻĄ¼Ļ░äņØä 0.3 mV/sņØś ņåŹļÅäļĪ£ ņāüņŖ╣ņŗ£Ēéżļ®░ ļÅäņČ£ļÉśļŖö ņĀäļźśļ░ĆļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņØ┤Ēøä, LPR ņŗżĒŚśņØä ĒåĄĒĢ┤ ņĖĪņĀĢĒĢ£ Rp Ļ░ÆņØĆ ņŗØ (6) ĒåĄĒĢ┤ ļÅäņČ£ĒĢśņśĆļŗż.
ņŚ¼ĻĖ░ņä£, RpļŖö ļČäĻĘ╣ ņĀĆĒĢŁ (╬®╬ćcm2), ļŖö ņØĖĻ░ĆļÉ£ ņĀäņ£ä Ļ░ÆņØś ļ│ĆĒÖöļ¤ē (V), ļŖö ņĖĪņĀĢļÉ£ ņĀäļźśļ░ĆļÅäņØś ļ│ĆĒÖöļ¤ē (A/cm2)ļź╝ ļéśĒāĆļéĖļŗż.
Stern-Geary ņŗØ (7) [18]ņØä ĒåĄĒĢ┤ ņŗ£ĒÄĖ ļ│ä ļČĆņŗØņĀäļźśļ░ĆļÅä (Corrosion current density, icorr)ļĪż ļÅäņČ£ĒĢśņśĆļŗż.
╬▓ļŖö Stern-Geary Ļ│äņłśļĪ£ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 0.03 Vļź╝ ņĀüņÜ®ĒĢśņśĆļŗż.
ļÅäņČ£ļÉ£ icorr Ļ░ÆņØĆ ņŗØ (8) [19]ņØä ĒåĄĒĢ┤ ļČĆņŗØ ņåŹļÅä (Corrsoion rate, C.R.)ļĪ£ ļ│ĆĒÖśļÉśņŚłļŗż.
ņŚ¼ĻĖ░ņä£, ŽüņØĆ ņŗ£ĒÄĖņØś ļ░ĆļÅä (g/cm3), ╬ĄņØĆ ņŗ£ĒÄĖņØś ļŗ╣ļ¤ē(g), FļŖö Ēī©ļ¤¼ļŹ░ņØ┤ ņāüņłś(C/mol)ļź╝ ļéśĒāĆļéĖļŗż. Ļ░ü ņŗ£ĒÄĖņØś ļīĆĒæ£ņĀüņØĖ ĒĢ®ĻĖł ņøÉņåī(Fe, Mn, Cr, Mo) ĒĢ©ļ¤ēņŚÉ ļö░ļØ╝ ļ░ĆļÅäņÖĆ ļŗ╣ļ¤ēņØä ļÅäņČ£ ĒĢśņśĆņ£╝ļ®░, ņŗ£ĒÄĖ ļ│ä ļ░ĆļÅäņÖĆ ļŗ╣ļ¤ēņØĆ Ļ░üĻ░ü ļŗżņØīĻ│╝ Ļ░Öļŗż (X65: 7.8599 g/cm3, 27.8953 g; X65 (Mo): 7.8623 g/cm3, 27.9634 g; X65 (Cr,Mo): 7.8658 g/cm3, 27.9405 g).
2.3 ļČĆņŗØĻ░Éļ¤ē ņĖĪņĀĢ
SiC paper #1200Ļ╣īņ¦Ć ņŚ░ļ¦łļÉ£ ņŗ£ĒÄĖ (35├Ś35├Ś5mm3)ņØä ļīĆņāüņ£╝ļĪ£ 1% NaCl + 1 g/L NaHCO3 + 1 bar CO2 ņłśņÜ®ņĢĪ ļé┤ 1, 2, 5, 7, 14ņØ╝ ļÅÖņĢł ņ╣©ņ¦Ć ĒĢśņśĆļŗż. ņ╣©ņ¦ĆņóģļŻī Ēøä ņŗ£ĒÄĖ Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉ£ ņāØņä▒ļ¼╝ņØĆ Clarke ņÜ®ņĢĪ (1000 mL HCl + 20 g Sb2O3+ 50 g SnCl2) [20]ņØä ņØ┤ņÜ®ĒĢśņŚ¼ 2ļČä ļÅÖņĢł ņ┤łņØīĒīī ņäĖņ▓ÖĒĢśņśĆļŗż. ņØ┤Ēøä, 0.1 mg ļŗ©ņ£äĻ╣īņ¦Ć ņĖĪņĀĢ Ļ░ĆļŖźĒĢ£ ņĀäņ×ÉņĀĆņÜĖņØä ĒÖ£ņÜ®ĒĢśņŚ¼ ņ╣©ņ¦Ć ņĀä ŌłÖ ĒøäņŚÉ ļö░ļźĖ Ļ░Éļ¤ē ļ¼┤Ļ▓īļź╝ ĒåĄĒĢ┤ ļ¼┤Ļ▓īĻ░Éļ¤ē (Weight loss) Ļ░Æ (ņŗØ (9))Ļ│╝, ļČĆņŗØ ņåŹļÅä (Corrosion rate, C.R.) Ļ░Æ (ņŗØ (10))ņØä ļÅäņČ£ĒĢśņśĆļŗż.
ņŚ¼ĻĖ░ņä£, W1ļŖö ņ╣©ņ¦Ć ņĀä ļ¼┤Ļ▓ī (g), W2ļŖö ņ╣©ņ¦Ć Ēøä ļ¼┤Ļ▓ī (g), AļŖö ņŗ£ĒÄĖ Ēæ£ļ®┤ņĀü (cm2), ╬öWļŖö ņŗ£ĒÄĖņØś ļ¼┤Ļ▓īĻ░Éļ¤ē (g/cm2), TļŖö ņ╣©ņ¦Ć ĻĖ░Ļ░ä (hours), ŽüņØĆ ņŗ£ĒÄĖņØś ļ░ĆļÅä (g/cm3)ļź╝ ļéśĒāĆļéĖļŗż.
2.4 ļČĆņŗØņāØņä▒ļ¼╝ ļČäņäØ ļ░Å ĒśĢņāü Ļ┤Ćņ░░
ņŗ£ĒÄĖ Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉ£ ļČĆņŗØņāØņä▒ļ¼╝ ļČäņäØņØä ņ£äĒĢ┤ ņ╣©ņ¦Ć ņŗżĒŚśņØ┤ ņłśĒ¢ēļÉ£ ņŗ£ĒÄĖņØä ļīĆņāüņ£╝ļĪ£ X-ņäĀ ĒÜīņĀłļČäņäØĻĖ░ (X-ray diffractometer, XRD)ņØä ĒÖ£ņÜ®ĒĢśņśĆļŗż. ļśÉĒĢ£, ļŗ©ļ®┤ ĒśĢņāü Ļ┤Ćņ░░ņØä ņ£äĒĢ┤ ņĮ£ļō£ļ¦łņÜ┤ĒīģļÉ£ ņŗ£ĒÄĖņØä SiC paper #2400Ļ╣īņ¦Ć ņŚ░ļ¦ł Ēøä 1 ╬╝mĻ╣īņ¦Ć ļ»ĖņäĖņŚ░ļ¦ł ĒĢśņśĆļŗż. ņØ┤Ēøä, FE-SEMņØä ĒÖ£ņÜ®ĒĢśņŚ¼ Ēæ£ŌłÖļŗ©ļ®┤ ĒśĢņāüņØä Ļ┤Ćņ░░ĒĢśņśĆĻ│Ā, ņŚÉļäłņ¦Ć ļČäņé░ĒśĢ ļČäĻ┤æļČäņäØļ▓Ģ (Energy dispersive X-ray spectroscopy, EDS)ņØä ĒåĄĒĢ┤ ņä▒ļČäļČäņäØņØä ņłśĒ¢ēĒĢśņśĆļŗż. ļśÉĒĢ£, ļČĆņŗØ ņ┤łĻĖ░ (1ņØ╝)ņŚÉ ĒśĢņä▒ļÉ£ ļČĆņŗØ ņāØņä▒ļ¼╝ņØś ĒŖ╣ņä▒ ļČäņäØņØä ņ£äĒĢ┤ X-ņäĀ Ļ┤æņĀäņ×É ļČäĻ┤æ ļČäņäØ (X-ray photoelectron spectroscope, XPS)ņØä ņłśĒ¢ēĒĢśņśĆļŗż. XPS ļČäņäØņØś Ļ▓ĮņÜ░, X-ņäĀ sourceļŖö Al-K╬▒ (1486.7 eV) ĒīīņןņØä ĒÖ£ņÜ®ĒĢśņśĆņ£╝ļ®░, ņĀäņĢĢ 15 kV, ļ╣öņĀäļźś 10 mA, spot Ēü¼ĻĖ░ 500 ╬╝m, Pass energy 20 eVņØś ņĪ░Ļ▒┤ņ£╝ļĪ£ ņłśĒ¢ēļÉśņŚłļŗż. Wide scanņŚÉņä£ļŖö ņŚÉļäłņ¦Ć ļ▓öņ£äļź╝ 0 ~ 1300 eVļĪ£ ĒĢśņŚ¼ Ēæ£ļ®┤ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņøÉņåīļź╝ ņĪ░ņé¼ĒĢ£ ļŗżņØī Narrow scanņØä ĒåĄĒĢ┤ Ļ░ü ņøÉņåīņŚÉ ļīĆĒĢ£ ļŹ░ņØ┤Ēä░ļź╝ ĒÖĢļ│┤ĒĢśņśĆļŗż. ļśÉĒĢ£, Spectral data processor v 3.0ņØä ņé¼ņÜ®ĒĢśņŚ¼ Žć2 Ļ░ÆņØä ņĄ£ņåīĒÖöĒĢśņŚ¼ ļŹ░ņØ┤Ēä░ļź╝ FittingĒĢśņśĆņ£╝ļ®░, Ļ░ü ņøÉņåīņŚÉ ļīĆĒĢ£ ĒÖöĒĢÖ Ļ▓░ĒĢ® ņāüĒā£ļź╝ ļÅäņČ£ĒĢśņśĆļŗż. Ļ░üĻ░üņØś ņāüņŚÉ ļīĆĒĢ£ ĒśĢņä▒ ļ╣äņ£© (%)ņØĆ Ļ░ü ņøÉņåī Ļ│ĪņäĀņØś ļ®┤ņĀüļ╣äļź╝ ĻĖ░ļ░śņ£╝ļĪ£ Ļ▓░ņĀĢļÉśņŚłļŗż. Ļ░üĻ░üņØś Ēö╝Ēü¼(peak)ļŖö C 1s ņśżļ╣äĒāł (orbital)ņØś 284.5 eVļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ļ│┤ņĀĢĒĢśņśĆļŗż[21]. ļśÉĒĢ£, 3ņ░©ņøÉ ļĀłņØ┤ņĀĆ Ēśäļ»ĖĻ▓Į (Three-dimensional laser microscope)ņØä ĒÖ£ņÜ®ĒĢśņŚ¼ 1% NaCl + 1 g/L NaHCO3 + 1 bar CO2 ņłśņÜ®ņĢĪ ļé┤ 3, 14ņØ╝ ļÅÖņĢł ņ╣©ņ¦ĆļÉ£ ņŗ£ĒÄĖņØä ļīĆņāüņ£╝ļĪ£ Ēæ£ļ®┤ ņĪ░ļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
3.1 ļ»ĖņäĖņĪ░ņ¦ü Ļ┤Ćņ░░
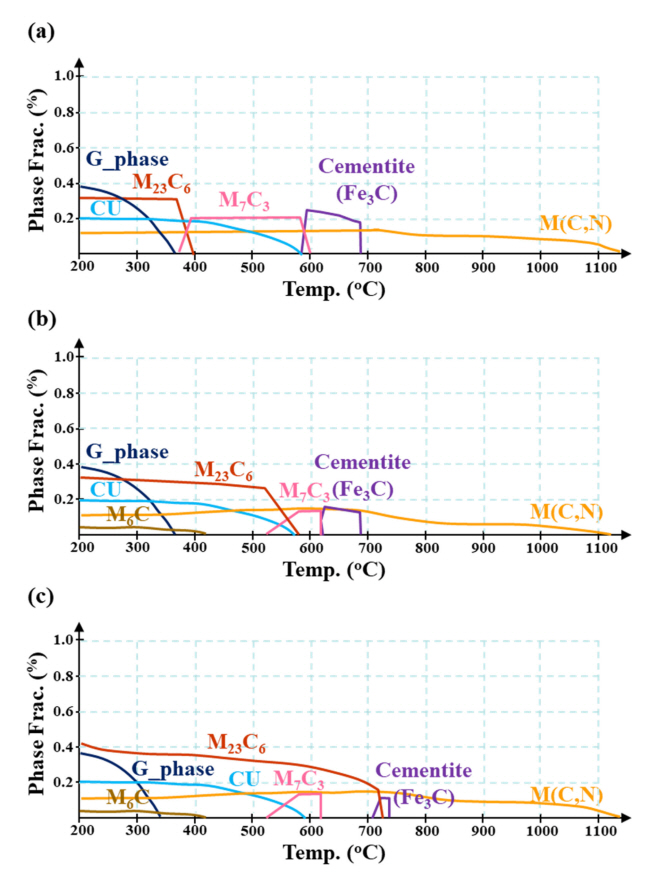
ĻĘĖļ”╝ 2ļŖö ņŗ£ĒÄĖ ļ│ä ļ»ĖņäĖņĪ░ņ¦ü ĒśĢņāüņØä ļéśĒāĆļéĖļŗż. ņäĖ ņŗ£ĒÄĖ ļ¬©ļæÉ ļ»ĖņäĖ ĒÄśļØ╝ņØ┤ĒŖĖ ĻĖ░ņ¦Ć ļé┤ ĻĘ╣Ē׳ ļ»Ėļ¤ēņØś ņŗ£ļ®śĒāĆņØ┤ĒŖĖĻ░Ć ņäØņČ£ (<0.3%)ļÉ£ ĻĄ¼ņĪ░ņØś ņĀäĒśĢņĀüņØĖ TMCP ņĀ£ņĪ░Ļ░ĢņØś ņĪ░ņ¦üņØä ļ│┤ņŚ¼ņŻ╝ļ®░, ļ»Ėļ¤ēņØś Cr ļ░Å Mo ņ▓©Ļ░ĆņŚÉ ļö░ļźĖ ņĪ░ņ¦üņĀü ņ░©ņØ┤ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż.
JMatProļź╝ ĒåĄĒĢ£ ņāü ņśłņĖĪ (ĻĘĖļ”╝ 3)ņØä ĒåĀļīĆļĪ£ 0.4 ~ 0.5 wt% ņłśņżĆņØś Cr ņ▓©Ļ░Ćļź╝ ĒåĄĒĢ┤ M23C6ņØś ņäØņČ£ ļČäņ£©/ņś©ļÅäņØś ņ”ØĻ░Ćļź╝ ņśłņāüĒĢ┤ ļ│╝ ņłś ņ׳ņ£╝ļéś FE-SEM ņłśņżĆņØś Ļ▒░ņŗ£ņĀüņØĖ Ļ┤Ćņ░░ņŚÉņä£ļŖö ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗż. ĒāäņåīĻ░Ģ ĻĖ░ļ░ś ņåīņ×¼ ļé┤ ļ»Ėļ¤ēņØś Cr ņ▓©Ļ░ĆļŖö ĒÅēĒśĢņĪ░Ļ▒┤ņØä Ļ░ĆņĀĢĒĢ£ ņāü ņśłņĖĪ Ļ▓░Ļ│╝ņÖĆ ņāüņØ┤ĒĢśĻ▓ī M7C3ņØś ņäØņČ£ņØ┤ ņÜ░ņäĖĒĢśĻ▓ī ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│Ā[22]ļÉśĻ│Ā ņ׳ņ£╝ļéś ņłśņŗŁ ļéśļģĖ ņłśņżĆņØś ļ»ĖņäĖ ņäØņČ£ļ¼╝ņØś Ļ▓ĮņÜ░ ļé┤ņŗØņä▒ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ ĻĘ╣Ē׳ ļ»Ėļ»ĖĒĢśņŚ¼ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļģ╝ņØśņØś ļ▓öņŻ╝ ņÖĖļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
3.2 ņĀäĻĖ░ĒÖöĒĢÖņĀü ļČĆņŗØĻ▒░ļÅÖ ļČäņäØ
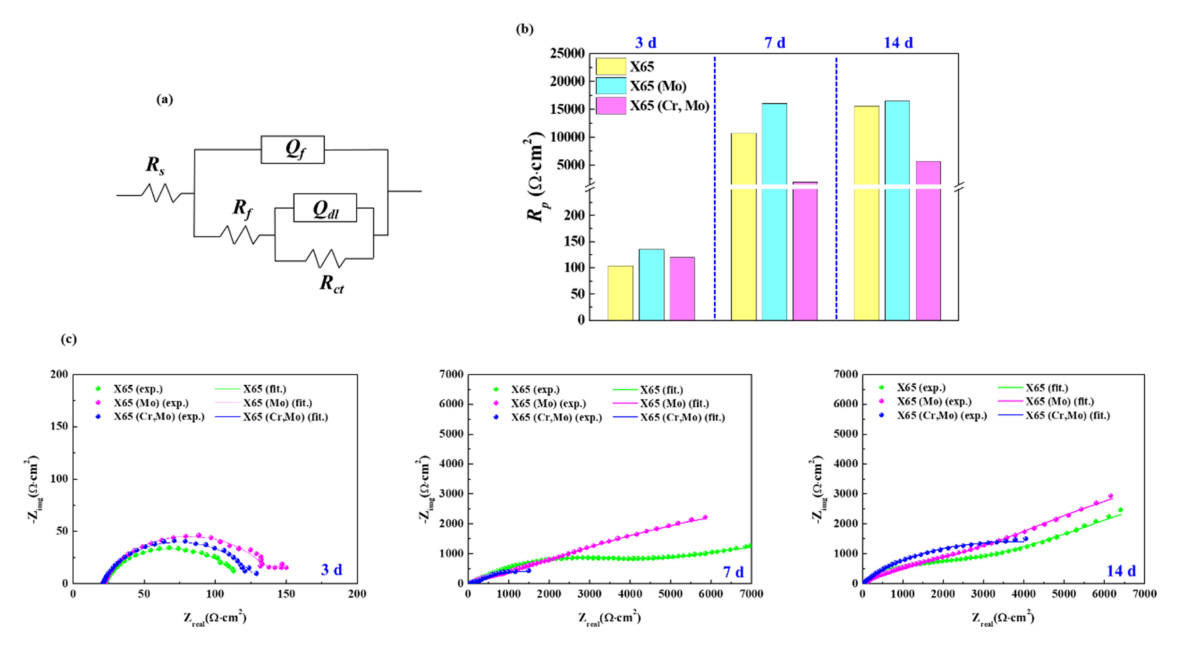
ĻĘĖļ”╝ 4ņØĆ ņĀĢņĀäņ£ä ļČäĻĘ╣ņŗżĒŚś Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż. ņ┤łĻĖ░ ņŗ£ņĀÉņØś Ļ▓ĮņÜ░ X65 (Cr,Mo) ņŗ£ĒÄĖņØś ņĀäļźśļ░ĆļÅä Ļ░ÆņØ┤ Ļ░Ćņן ļåÆņØĆ ņłśņżĆņ£╝ļĪ£ ņĖĪņĀĢļÉśņŚłļŖöļŹ░ ņØ┤ļŖö Fe ļīĆļ╣ä Ēæ£ņżĆĒÖśņøÉņĀäņ£äĻ░Ć ļé«ņØĆ CrņØś ņ¢æĻĘ╣ņÜ®ĒĢ┤ļ░śņØæ (Cr ŌåÆ Cr3+ + 3e-) ņåŹļÅäĻ░Ć ļåÆņØĆ ļŹ░ņŚÉ ļö░ļźĖ Ļ▓░Ļ│╝ļĪ£ ņØ┤ĒĢ┤ĒĢĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņ╣©ņ¦Ćņŗ£Ļ░ä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņĀäļźśļ░ĆļÅä Ļ░ÆņØś ņ¦ĆņåŹņĀü Ļ░ÉņåīĻ▒░ļÅÖņØ┤ ļéśĒāĆļé¼ļŗż. ļ░śļ®┤, X65 ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ ņ╣©ņ¦Ćņŗ£Ļ░ä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņĀäļźśļ░ĆļÅä Ļ░ÆņØ┤ ņĀÉņ░© ņ”ØĻ░ĆĒĢśļ®░ Ļ░Ćņן ļåÆņØĆ ņłśņżĆņØä ļ│┤ņśĆļŗż. X65 (Mo)ļŖö ņ╣©ņ¦Ć ņĀä ĻĄ¼Ļ░äņŚÉ Ļ▒Ėņ│É ļīĆņ▓┤ļĪ£ Ļ░Ćņן ļé«ņØĆ ņłśņżĆņØś ņĀäļźśļ░ĆļÅä Ļ░ÆņØ┤ ņ£Āņ¦ĆļÉśļ®░ X65 (Cr,Mo) ņŗ£ĒÄĖĻ│╝ ņ£Āņé¼ĒĢśĻ▓ī ņĀäļźśļ░ĆļÅä Ļ░ÆņØś ņĢłņĀĢņĀü ņĀ£ņ¢┤Ļ░Ć Ļ░ĆļŖźĒĢ©ņØä ņČöņĖĪĒĢĀ ņłś ņ׳ļŗż. ņ╣©ņ¦Ćņŗ£Ļ░ä ņןĻĖ░ĒÖöņŚÉ ļö░ļźĖ ļé┤ņŗØņä▒ņØś Ļ▒░ļÅÖņØĆ Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉśļŖö ļČĆņŗØņāØņä▒ļ¼╝ņØś ņóģļźś ļ░Å ĒŖ╣ņä▒ņŚÉ Ēü¼Ļ▓ī ņóīņÜ░ļÉśļŖöļŹ░[23], ĻĖłņåŹ Ēæ£ļ®┤ņØä ļīĆņāüņ£╝ļĪ£ ņ¦ĆņåŹņĀüņØĖ ņ¢æĻĘ╣ ņÜ®ņČ£ņØä ņ£ĀļÅäĒĢśļŖö ņĀĢņĀäņ£ä ļČäĻĘ╣ņŗżĒŚśņ£╝ļĪ£ ņןĻĖ░ņĀüņØĖ ļČĆņŗØĻ▒░ļÅÖņØä ņØ┤ĒĢ┤ĒĢśļŖö ļŹ░ņŚÉļŖö ĒĢ£Ļ│äĻ░Ć ņĪ┤ņ×¼ĒĢ£ļŗż.
ņןņŗ£Ļ░ä LPR ņŗżĒŚś ņłśĒ¢ēņØä ĒåĄĒĢ£ Ļ▓░Ļ│╝ (ĻĘĖļ”╝ 5 ļ░Å Ēæ£ 2) ļĪ£ ĒīÉļŗ©ņ╗©ļīĆ ņ╣©ņ¦Ć 3ņØ╝ ņŗ£ņĀÉĻ╣īņ¦ĆļŖö ņäĖ ņŗ£ĒÄĖ ļ¬©ļæÉ 2 mm/year ņØ┤ņāüņØś ļåÆņØĆ ņłśņżĆņØś ļČĆņŗØņåŹļÅäļź╝ ļ│┤ņśĆņ£╝ļéś, X65 (Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ ļČĆņŗØņåŹļÅäĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļé«ņØĆ ņłśņżĆņ£╝ļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ļ░śļ®┤, ņ╣©ņ¦Ć 7ņØ╝ ĒøäņŚÉļŖö ņäĖ ņŗ£ĒÄĖ ļ¬©ļæÉ ļČĆņŗØņåŹļÅäĻ░Ć ļ»Ėļ»ĖĒĢ£ ņłśņżĆ (<0.2 mm/year)ņ£╝ļĪ£ Ļ░ÉņåīĒĢ©ņØä ņĢī ņłś ņ׳ļŗż. ļ│┤ļŗż ņןĻĖ░ĒÖöļÉ£ ņŗ£ņĀÉ (14ņØ╝ Ēøä)ņŚÉņä£ļŖö X65 (Mo)ļź╝ ņĀ£ņÖĖĒĢ£ ļæÉ ņŗ£ĒÄĖņØś ļČĆņŗØņåŹļÅäļŖö ļŗżņåī ņ”ØĻ░ĆļÉśņŚłĻ│Ā ĻĘĖ ņżæ X65 (Cr,Mo) ņŗ£ĒÄĖņØś ļČĆņŗØņåŹļÅäĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ Ļ░Ćņן ļåÆĻ▓ī ļÅäņČ£ļÉśņŚłļŗż. ņ╣©ņ¦Ć ņןĻĖ░ĒÖöņŚÉ ļö░ļØ╝ ņåīņ×¼ Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉśļŖö ņāØņä▒ļ¼╝ņØ┤ Ļ░Ģņ×¼ņØś ļČĆņŗØļ░śņØæņØä ņĀ£ņ¢┤ĒĢśļŖöļŹ░ņŚÉ ĒÜ©Ļ│╝ņĀüņØĖ Ļ▓āņ£╝ļĪ£ ņČöņĖĪļÉśļéś ņןĻĖ░ņĀüņØĖ ņĢłņĀĢļÅäļŖö ņŗ£ĒÄĖņŚÉ ļö░ļØ╝ ņāüņØ┤ĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ņØ┤ņÖĆ Ļ░ÖņØĆ Ļ▒░ļÅÖņØĆ EIS ņŗżĒŚś Ļ▓░Ļ│╝ (ĻĘĖļ”╝ 6 ļ░Å Ēæ£ 3)ņŚÉņä£ļÅä ņ£Āņé¼ĒĢśĻ▓ī ļéśĒāĆļé¼ļŗż. ņ╣©ņ¦Ć ņ┤łĻĖ░ ņŗ£ņĀÉņØś ļé«ņØĆ ļČäĻĘ╣ņĀĆĒĢŁ Ļ░Æ (ļīĆļץ 200 ╬®┬Ęcm2)Ļ│╝ ņĀĆņŻ╝Ēīī ņśüņŚŁņŚÉņä£ņØś ņØ┤ņś©ĒØĪņ░®ņŚÉ ĻĖ░ņØĖĒĢśņŚ¼ ļéśĒāĆļéśļŖö Inductive loopņØś Ļ▒░ļÅÖņØ┤ ļéśĒāĆļé¼ļŗż. ņ”ē, ņŚ╝ĒÖöņØ┤ņś©ņØ┤ ĒżĒĢ©ļÉ£ ņłśņÜ®ņĢĪ ļé┤ņŚÉņä£ Ļ░Ģņ×¼ Ēæ£ļ®┤ņŚÉļŖö FeCl+, FeCl2+, FeCl2+ņØś ĒśĢņä▒ ļ░Å ĒØĪņ░®[24]ņŚÉ ĻĖ░ņØĖĒĢśņŚ¼ FeņØś ņ¢æĻĘ╣ņÜ®ĒĢ┤ļ░śņØæ (Fe ŌåÆ Fe2+ + 2e-)ņØ┤ ņ┤ēņ¦äļÉśļŖö Ļ▒░ļÅÖņØä ņśłņāüĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. ņ╣©ņ¦Ć ĒøäĻĖ░ ņŗ£ņĀÉņŚÉņä£ļŖö ļåÆņØĆ ņłśņżĆņØś ļČäĻĘ╣ņĀĆĒĢŁ Ļ░Æ (ļīĆļץ 5000 ~ 15000 ╬®┬Ęcm2)ņØ┤ ļÅäņČ£ļÉśņŚłĻ│Ā Ēæ£ļ®┤ ņāØņä▒ļ¼╝ ĒśĢņä▒ņŚÉ ļö░ļźĖ ļČĆņŗØļ░śņØæ ņ¢ĄņĀ£ĒÜ©Ļ│╝ļź╝ ņČöņĖĪĒĢĀ ņłś ņ׳ļŗż. ņØ┤ Ļ▓ĮņÜ░ņŚÉņä£ļÅä X65 (Mo) ņŗ£ĒÄĖņØś ļČäĻĘ╣ņĀĆĒĢŁņØ┤ Ļ░Ćņן ļåÆņØĆ ļ░śļ®┤ X65 (Cr,Mo) ņŗ£ĒÄĖņØś ļČäĻĘ╣ņĀĆĒĢŁ Ļ░ÆņØ┤ Ļ░Ćņן ļé«Ļ▓ī ļéśĒāĆļé¼ļŗż.
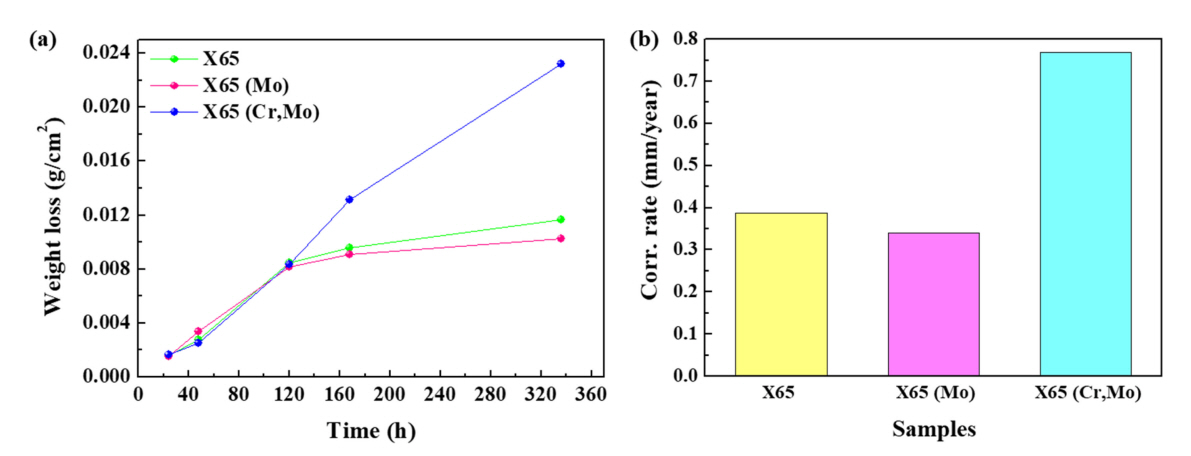
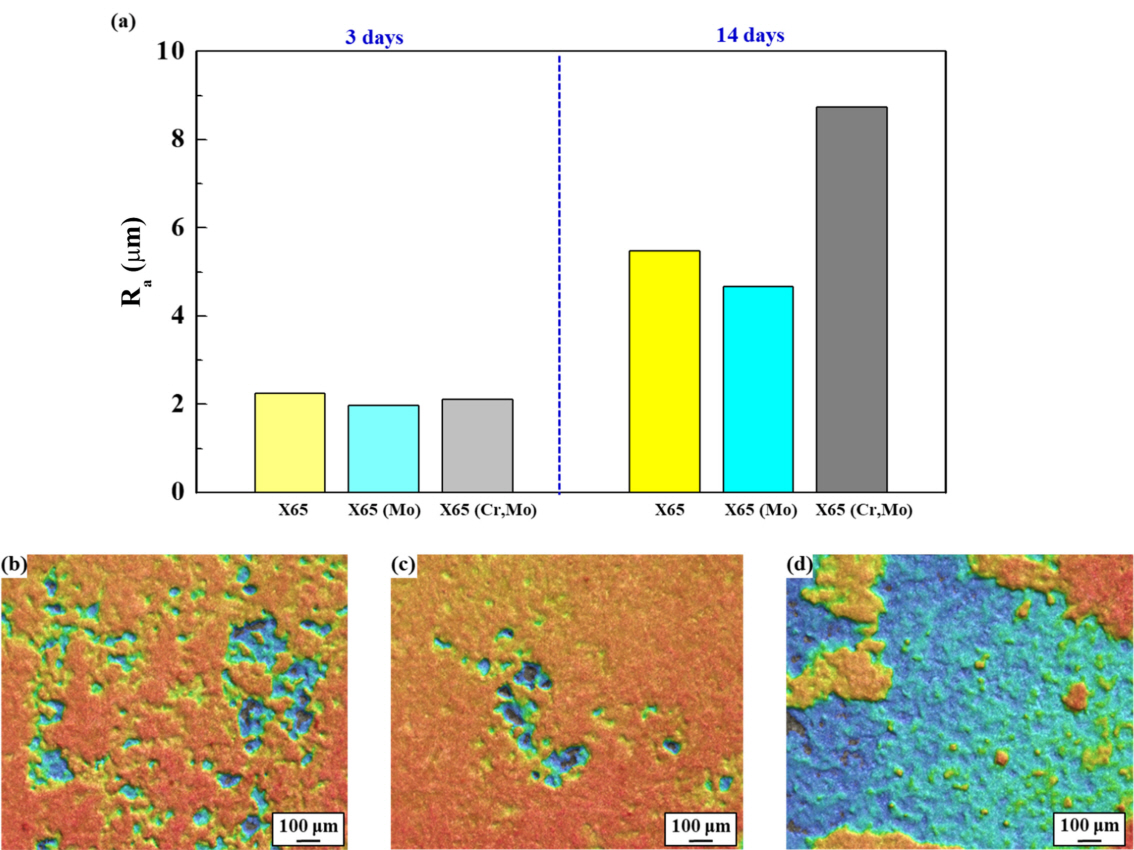
3.3 ļ¼┤Ļ▓īĻ░Éļ¤ē ļČäņäØ
ĻĘĖļ”╝ 7(a)ņØĆ ņĀäĻĖ░ĒÖöĒĢÖ ņŗżĒŚśņŚÉņä£ņÖĆ ļÅÖņØ╝ ĒÖśĻ▓Į ļé┤ ņ╣©ņ¦Ć ņŗ£Ļ░äņŚÉ ļö░ļźĖ ļ¼┤Ļ▓īĻ░Éļ¤ē ņĖĪņĀĢ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļéĖ Ļ▓āņØ┤ļŗż. X65 (Cr,Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ ņ╣©ņ¦Ćņŗ£Ļ░ä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ Ļ░Éļ¤ē ņłśņżĆņØ┤ ļīĆņ▓┤ļĪ£ ļ╣äļĪĆņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśļŖö Ļ▒░ļÅÖņØä ļ│┤ņØĖ ļ░śļ®┤, X65 ņÖĆ X65 (Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ ņ”ØĻ░ĆņåŹļÅäĻ░Ć ņĀÉņ░© ļæöĒÖöļÉśļŖö Parabolic ņ”ØĻ░Ć Ļ▒░ļÅÖņØä ļ│┤ņśĆļŗż. ņ╣©ņ¦Ć ĒøäĻĖ░ (14ņØ╝) ļ¼┤Ļ▓īĻ░Éļ¤ē ļŹ░ņØ┤Ēä░ļź╝ ĒåĀļīĆļĪ£ ļČĆņŗØ ņåŹļÅäļź╝ ļÅäņČ£ĒĢ£ Ļ▓░Ļ│╝ (ĻĘĖļ”╝ 7(b)), X65 (Mo) < X65 < X65 (Cr,Mo) ņł£ņä£ļĪ£ ļČĆņŗØņåŹļÅäĻ░Ć ļåÆĻ▓ī ĒÅēĻ░ĆļÉśņ¢┤, ņĀäĻĖ░ĒÖöĒĢÖņĀü ļČĆņŗØĻ▒░ļÅÖ ļČäņäØ Ļ▓░Ļ│╝ņÖĆ ņāüņØæĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ļīĆņāü ĒÖśĻ▓ĮņØĖ CO2 ĒżĒÖö ņżæņä▒ ņłśņÜ®ņĢĪ ņĪ░Ļ▒┤ (pH: 6)ņŚÉņä£ Ļ░Ģņ×¼ Ēæ£ļ®┤ņŚÉļŖö ņŗØ (11)Ļ│╝ (12)ņØä ĒåĀļīĆļĪ£ FeCO3 ļśÉļŖö Fe2(OH)2CO3Ļ░Ć ņäØņČ£ļÉ©ņØä ņśłņāüĒĢ┤ ļ│╝ ņłś ņ׳ļŗż.
ņŚ┤ņŚŁĒĢÖņĀü Ļ┤ĆņĀÉņŚÉņä£ FeCO3ļŖö pHĻ░Ć ņżæņä▒ņŚÉņä£ ņŚ╝ĻĖ░ņä▒ ņśüņŚŁņ£╝ļĪ£ ĒÖĢņןļÉĀ ļĢī ĻĘĖ ņĢłņĀĢļÅäĻ░Ć ļåÆņĢäņ¦ÉņØä ņśłņāüĒĢĀ ņłś ņ׳Ļ│Ā, ņŗżņĀ£ļĪ£ Ļ░Ģņ×¼ņØś ļČĆņŗØņåŹļÅäĻ░Ć ĻĘ╣Ē׳ ļé«ņØĆ ņłśņżĆņ£╝ļĪ£ ņĀ£ņ¢┤ļÉśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[25]. ņØ╝ļ░śņĀüņ£╝ļĪ£ Bulk ņÜ®ņĢĪ ļé┤ pH ļīĆļ╣ä ļČĆņŗØļ░śņØæņØ┤ ļ░£ņāØĒĢśļŖö Ļ░Ģņ×¼ Ēæ£ļ®┤ ņ¦üņāüļČĆņŚÉņä£ņØś pHļŖö ļåÆņØĆ ņłśņżĆ[26]ņØ┤ļ®░, ļśÉĒĢ£ Water chemistry ņØ┤ļĪĀņŚÉ ļö░ļź┤ļ®┤, Ļ░Ģņ×¼ Ēæ£ļ®┤ņŚÉņä£ ņ¢æĻĘ╣ ņÜ®ĒĢ┤ļ░śņØæņØä ĒåĄĒĢ┤ ņÜ®ņČ£ļÉśļŖö ĻĖłņåŹ ņ¢æņØ┤ņś©(Fe2+, Cr3+)ņØś ņ¢æņØ┤ ņ”ØĻ░ĆļÉ©ņŚÉ ļö░ļØ╝ ļ¼╝ ļČäņ×ÉņØś ĒĢ┤ļ”¼(OH- ņāØņä▒)ņŚÉ ĻĖ░ņØĖĒĢśņŚ¼ ņÜ®ņĢĪņØś pHĻ░Ć ņ”ØĻ░ĆļÉ£ļŗż. ļö░ļØ╝ņä£, CO32- ļ░Å FeCO3ņØś ņŚ┤ņŚŁĒĢÖņĀü ņĢłņĀĢļÅäĻ░Ć ņ”ØĻ░ĆļÉ©ņØä ļ░öĒāĢņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ĒÖśĻ▓ĮņĪ░Ļ▒┤ ļé┤ Ļ░Ģņ×¼ņØś ļé┤ņŗØņä▒ņØä ņóīņÜ░ĒĢśļŖö Ļ▓āņØĆ FeCO3ņØś ņĢłņĀĢļÅäļĪ£ Ļ░äņŻ╝ĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. ņ”ē, ņĀäĻĖ░ņĀäļÅäņä▒ņØ┤ ĻĘ╣Ē׳ ļé«ņĢä ļČĆļÅäņ▓┤ļĪ£ Ļ░äņŻ╝ļÉśļŖö FeCO3Ļ░Ć Ļ░Ģņ×¼ Ēæ£ļ®┤ņŚÉ ņ╣śļ░ĆĒĢ£ ĒśĢĒā£ļĪ£ ņäØņČ£ļÉĀ ļĢī Ļ░Ćņן ņÜ░ņłśĒĢ£ ļé┤ņŗØņä▒ ĒÖĢļ│┤Ļ░Ć Ļ░ĆļŖźĒĢĀ ņłś ņ׳ļŗż. ļ░śļ®┤, ļ»Ėļ¤ēņØś Cr ļ░Å Mo ņ▓©Ļ░Ćļź╝ ĒåĄĒĢ£ ĒĢ®ĻĖłņØĆ Ļ░Ģņ×¼ Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉśļŖö ņāØņä▒ļ¼╝ņØś ĒŖ╣ņä▒ņØä ļ│ĆĒÖöņŗ£Ēé¼ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ĒŖ╣Ē׳ Cr ņ▓©Ļ░ĆņØś Ļ▓ĮņÜ░, FeCr2O4 [27] ļśÉļŖö Cr(OH)3 [28]ņØś ĒśĢņä▒ņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļ®░, ļ╣äņĀĢņ¦łņØś Cr(OH)3ņØś ĒśĢņä▒ (ņŗØ (13) ļ░Å (14))Ļ│╝ Ļ░Ģņ×¼ņØś ļé┤ņŗØņä▒ Ē¢źņāü ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ļ¦ÄņØĆ ņäĀĒ¢ēņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżņØ┤ ņĪ┤ņ×¼ĒĢ£ļŗż[29-31]. Mo ņ▓©Ļ░Ć ļśÉĒĢ£ ņŗØ (15), (16), (17)ņŚÉņä£ ļéśĒāĆļé£ ļ░öņÖĆ Ļ░ÖņØ┤ Ļ░ĆņłśļČäĒĢ┤ ļ░śņØæņØä ĒåĄĒĢ┤ Mo(OH)3, MoO2ņØś ĒśĢņä▒ņØ┤ Ļ░ĆļŖźĒĢśļŗż[32].
ĒĢśņ¦Ćļ¦ī, ļ│Ė ņŚ░ĻĄ¼Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤ ļ»Ėļ¤ēņØś MoņÖĆ ĒĢ©Ļ╗ś CrņØś ļ│ĄĒĢ®ņ▓©Ļ░ĆļŖö ņןĻĖ░ ļé┤ņŗØņä▒ņØä ņĀĆĒĢśņŗ£Ēéżļ®░, ļ»Ėļ¤ēņØś Mo ļŗ©ļÅģ ņ▓©Ļ░ĆņØś Ļ▓ĮņÜ░ņŚÉ ĒĢ£ĒĢśņŚ¼ ļé┤ņŗØņä▒ Ē¢źņāü ĒÜ©Ļ│╝Ļ░Ć ņĪ┤ņ×¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņØ┤ņŚÉ ļīĆĒĢ£ ļ®öņ╗żļŗłņ”śņĀü ļģ╝ņØśņŚÉ ņĢ×ņä£ ņŗżņĀ£ļĪ£ Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉ£ ņāØņä▒ļ¼╝ņØś ņóģļźś, ĒśĢņä▒ĒśĢĒā£, ņä▒ļČäļČäĒż ļō▒ņØś ļČäņäØĻ▓░Ļ│╝ļź╝ ļŗżņØī ņĀłņŚÉ ņ×ÉņäĖĒ׳ ņĀ£ņŗ£ĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
3.4 ļČĆņŗØņāØņä▒ļ¼╝ ļČäņäØ
ĻĘĖļ”╝ 8Ļ│╝ 9ļŖö ļČĆņŗØĒÖśĻ▓Į ņĪ░Ļ▒┤ ļé┤ņŚÉņä£ Ļ░ü ņ╣©ņ¦Ć ņŗ£Ļ░ä (7ņØ╝, 14ņØ╝)ļÅÖņĢł ņ╣©ņ¦Ć Ēøä Ēæ£ļ®┤ ļ░Å ļŗ©ļ®┤ļČĆ ĒśĢņāüĻ┤Ćņ░░ ļ░Å ņä▒ļČäļČäņäØ ņłśĒ¢ē Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż. 7ņØ╝ ļÅÖņĢł ņ╣©ņ¦Ć Ēøä Ēæ£ļ®┤ Ļ┤Ćņ░░ Ļ▓░Ļ│╝, ņäĖ ņŗ£ĒÄĖ ļ¬©ļæÉ Ēæ£ļ®┤ņŚÉ ĻĄ¼ĒśĢņØś ņ×ģņ×ÉļōżņØ┤ Fe ĻĖ░ļ░ś ņāØņä▒ļ¼╝ņØä ĒśĢņä▒ĒĢśļ®░ ņäØņČ£ļÉ£ ĒśĢņāüņØä ļ│┤ņśĆļŗż. ĒĢśņ¦Ćļ¦ī ļŗ©ļ®┤ļČĆņŚÉņä£ļŖö X65 ņŗ£ĒÄĖ Ēæ£ļ®┤ ņāØņä▒ļ¼╝ņØś ņĀäņ▓┤ ļæÉĻ╗śĻ░Ć Ļ░Ćņן ļæÉĻ╗ŹĻ│Ā ļŗżņåī ļČłĻĘĀņØ╝ĒĢ£ Ļ│äļ®┤ ĒśĢņāüņØä ļ│┤ņØĖ ļ░śļ®┤, X65 (Mo) ņŗ£ĒÄĖņŚÉņä£ļŖö Ļ░Ćņן ņ¢ćņØĆ ņāØņä▒ļ¼╝Ļ│╝ ĻĘĀņØ╝ĒĢ£ Ļ│äļ®┤ ĒśĢņāüņØä ļ│┤ņśĆļŗż. ĒĢ£ĒÄĖ X65 (Cr,Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ Fe ĻĖ░ļ░ś ņāØņä▒ļ¼╝ (+1ļ▓ł ņśüņŚŁ)Ļ│╝ Cr ĻĖ░ļ░ś ņāØņä▒ļ¼╝ (+2ļ▓ł ņśüņŚŁ)ņØ┤ Ēś╝ņ×¼ļÉśņ¢┤ ņĪ┤ņ×¼ĒĢśļ®░ ļČłņŚ░ņåŹņĀüņØĖ ļČĆņŗØņāØņä▒ļ¼╝ ļ░Å Ļ░Ćņן ļČłņĢłņĀĢĒĢ£ Ļ│äļ®┤ ĒśĢņāüņØ┤ ļéśĒāĆļé¼ļŗż. ņ¦Éņ×æņ╗©ļīĆ, ļ»Ėļ¤ē ņ▓©Ļ░ĆļÉ£ CrņØś ņÜ░ņäĀ ņÜ®ĒĢ┤ļĪ£ ņāØņä▒ļ¼╝ ļé┤Ļ░üņĖĄņŚÉ Cr ļåŹĒÖö ņāØņä▒ļ¼╝ņØ┤ ĒśĢņä▒ļÉśļŖöļŹ░, ĻĘĖ ņāüļČĆņĖĄņŚÉļŖö Fe ĻĖ░ļ░ś ņāØņä▒ļ¼╝ņØś ņäØņČ£ņØ┤ ņĢłņĀĢņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ļ╣äĻĄÉņĀü ņĢĮņé░ņä▒ ļČäņ£äĻĖ░ ļé┤ņŚÉņä£ ņĢłņĀĢņĀüņØĖ ņāüņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ Cr ņé░ĒÖöļ¼╝ (Cr2O3, Cr(OH)3)ņØś ĒŖ╣ņä▒[33] ļ░Å ļČłņČ®ļČäĒĢ£ Cr ĒĢ©ļ¤ēņØä Ļ│ĀļĀżĒĢśņśĆņØä ļĢī ļ│Ė ņŗżĒŚś ņĪ░Ļ▒┤ (ņÜ®ņĢĪņØś ņ┤łĻĖ░ pH: 6) ĒĢśņŚÉņä£ļŖö Cr ļåŹĒÖö ņé░ĒÖöļ¼╝ņØś ņĢłņĀĢņĀü ĒśĢņä▒ņØ┤ ņ¢┤ļĀżņÜĖ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ņŗ£ĒÄĖļōż Ļ░ä ņāØņä▒ļ¼╝ ļ░Å Ļ│äļ®┤ ĒśĢĒā£ļŖö ņ╣©ņ¦Ć ĒøäĻĖ░ (14ņØ╝, ĻĘĖļ”╝ 9) ņŗ£ņĀÉņŚÉņä£ļÅä ņ£Āņé¼ĒĢśĻ▓ī ļéśĒāĆļé¼ļŖöļŹ░, X65 (Mo)ļź╝ ņĀ£ņÖĖĒĢ£ ļæÉ ņŗ£ĒÄĖņØĆ ņāØņä▒ļ¼╝ņØś ļæÉĻ╗śĻ░Ć ĒśäņĀĆĒ׳ ļæÉĻ║╝ņøīņĪīņ£╝ļ®░ ĒŖ╣Ē׳ X65 (Cr,Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ Ļ│äļ®┤ ļČłņĢłņĀĢļÅäĻ░Ć Ļ░Ćņן ļæÉļō£ļ¤¼ņĪīĻ│Ā ĒāĆ ņŗ£ĒÄĖļōżĻ│╝ ņāüņØ┤ĒĢśĻ▓ī ņÖĖĻ░üņĖĄ ņāØņä▒ļ¼╝ ņé¼ņØ┤ļĪ£ ļé┤Ļ░üņĖĄņØś Cr ļ░Å Mo ļåŹĒÖöĻ░Ć ļéśĒāĆļé¼ņ£╝ļ®░ ņāØņä▒ļ¼╝ ĻĄ¼ņä▒ņ×ģņ×ÉņØś ņä▒ņןņ£╝ļĪ£ Ļ░Ćņן Ēü░ ņ×ģņ×É ĒśĢĒā£ļź╝ ļ│┤ņśĆļŗż.
3ņ░©ņøÉ Ēæ£ļ®┤ņĪ░ļÅä ļČäņäØ Ļ▓░Ļ│╝ (ĻĘĖļ”╝ 10)ņŚÉņä£ļÅä ņ£Āņé¼ĒĢ£ Ļ▒░ļÅÖņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ņ╣©ņ¦Ć ņ┤łĻĖ░ (3ņØ╝)ņÖĆ ļŗ¼ļ”¼ ĒøäĻĖ░ ņŗ£ņĀÉ (14ņØ╝)ņŚÉņä£ļŖö ļ¼┤Ļ▓īĻ░Éļ¤ē ņłśņżĆĻ│╝ ņ£Āņé¼ĒĢ£ Ļ▓ĮĒ¢źņ£╝ļĪ£ Ēæ£ļ®┤ņĪ░ļÅä Ļ░ÆņØś ņ░©ņØ┤Ļ░Ć ļæÉļō£ļ¤¼ņĪīļŗż.
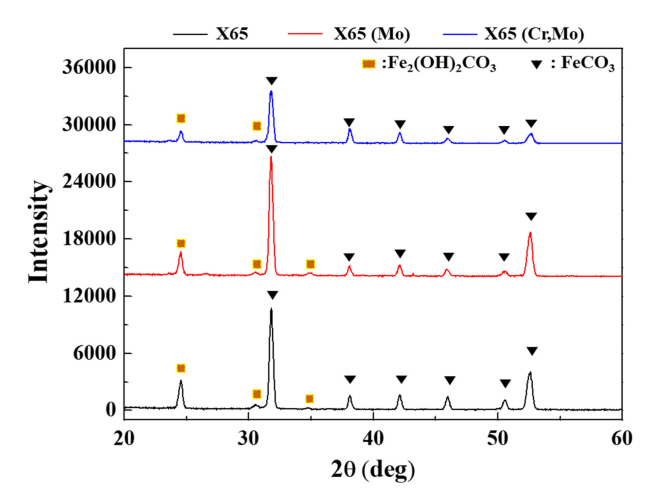
14ņØ╝ļÅÖņĢł ņ╣©ņ¦Ć Ēøä XRD ļČäņäØ Ļ▓░Ļ│╝ (ĻĘĖļ”╝ 11), ļ¬©ļōĀ ņŗ£ĒÄĖņŚÉņä£ FeCO3ņÖĆ Fe2(OH)2CO3 ņāØņä▒ļ¼╝ņØś PeakņØ┤ ļéśĒāĆļé¼ņ£╝ļ®░, ļīĆņ▓┤ļĪ£ ļ╣äņĀĢņ¦ł ņāØņä▒ļ¼╝ļĪ£ ņĢīļĀżņ¦ä Cr(OH)3ļŖö Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. ņäĀĒ¢ēļ¼ĖĒŚī[34]ņŚÉ ļö░ļź┤ļ®┤ CO2 ĒÖśĻ▓Į ļé┤ ņĢłņĀĢņāüņ£╝ļĪ£ ņĢīļĀżņ¦ä FeCO3ņÖĆ ņżĆņĢłņĀĢņāüņØĖ Fe2(OH)2CO3ņØś ĒśĢņä▒ ļ╣äņ£©ņØä ĒåĄĒĢ┤ ļČĆņŗØņāØņä▒ļ¼╝ņØś ņĢłņĀĢļÅäļź╝ Ļ░äņĀæņĀüņ£╝ļĪ£ ĒīÉļŗ©ĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļĢī, FeCO3 ļČäņ£©ņØ┤ ļåÆņØäņłśļĪØ ļČĆņŗØņāØņä▒ļ¼╝ņØś ņĢłņĀĢļÅäĻ░Ć ļåÆņĢä ļé┤ņŗØņä▒ Ē¢źņāüņŚÉ ļīĆĒĢ£ ĻĖ░ņŚ¼ļÅäĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśļŖöļŹ░, X65 (Mo)ņØś Ļ▓ĮņÜ░ FeCO3 PeakņØś IntensityĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļåÆĻ▓ī ļéśĒāĆļé£ ļ░śļ®┤ X65 (Cr,Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ FeCO3 PeakņØś IntensityĻ░Ć ļé«Ļ▓ī ļéśĒāĆļé¼ļŗż. Cr ņāØņä▒ļ¼╝ņØś ĻĄŁļČĆņĀüņØĖ ĒśĢņä▒ņØĆ ļ│┤ļŗż ņĢłņĀĢņĀü ĒśĢĒā£ņØĖ FeCO3ņØś ņäØņČ£ņØä ņ¦ĆņŚ░ņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņČöņĖĪļÉ£ļŗż.
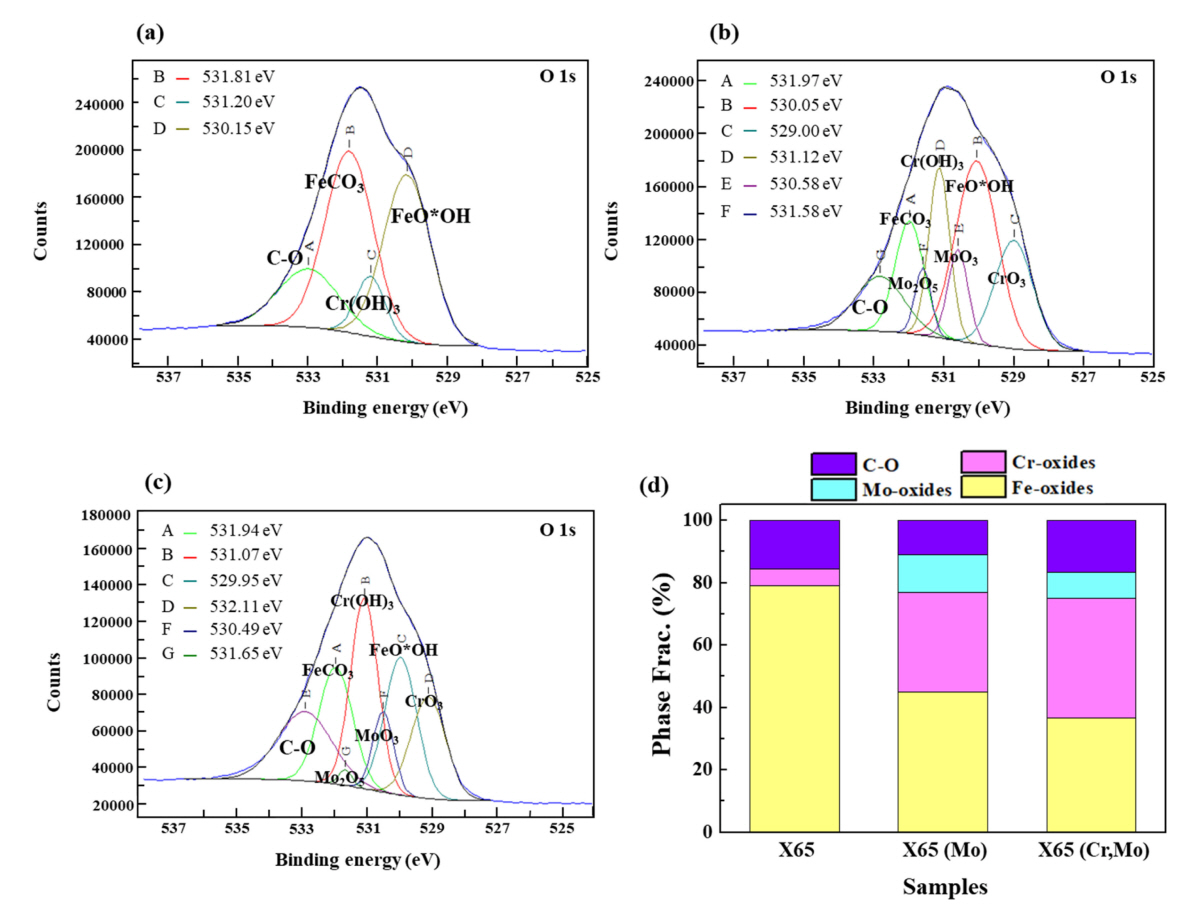
ĻĘĖļ”╝ 12ņŚÉ ļČĆņŗØ ņ┤łĻĖ░Ļ│╝ņĀĢņŚÉņä£ņØś XPS ļČäņäØĻ▓░Ļ│╝ (O 1s ĻĖ░ņżĆ)ļź╝ ļéśĒāĆļé┤ņŚłļŗż. X65 ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ Ēæ£ļ®┤ ņāØņä▒ļ¼╝ ņżæ Fe Ļ│äņŚ┤ ņé░ĒÖöļ¼╝ņØ┤ ļīĆļץ 80%ņØś ļČäņ£©ņØä ņ░©ņ¦ĆĒĢśņśĆĻ│Ā ĻĘĖ ņżæ FeCO3 ņāØņä▒ļ¼╝ņØ┤ Ļ░Ćņן ņÜ░ņäĖĒĢśĻ▓ī ĒśĢņä▒ļÉ£ ļ░śļ®┤, X65 (Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ Mo ņé░ĒÖöļ¼╝ (MoO3, Mo2O5)ņØ┤ ņØ╝ļČĆ ļČäņ£©ņØä ņ░©ņ¦ĆĒĢśņśĆņ£╝ļ®░ X65 ņŗ£ĒÄĖĻ│╝ ļÅÖņØ╝ĒĢ£ Cr ĒĢ©ļ¤ē (<0.2 wt% Cr)ņ×äņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā Cr ņé░ĒÖöļ¼╝ņØś ļČäņ£© ļśÉĒĢ£ ņāüļīĆņĀüņ£╝ļĪ£ ļåÆĻ▓ī ļéśĒāĆļé¼ļŗż. CO2 ĒÖśĻ▓Į ļé┤ Cr, Mo ļ│ĄĒĢ® ņ▓©Ļ░Ć ņŗ£, MoļŖö ņ╣©ņ¦Ć ņ┤łĻĖ░ņŚÉ Cr ņé░ĒÖöļ¼╝ņØś ņĢłņĀĢņĀü ĒśĢņä▒ņØä ņ┤ēņ¦äņŗ£ĒéżļŖö ļŹ░ņŚÉ ļö░ļźĖ Ļ▓░Ļ│╝[35]ļĪ£ ņČöņĖĪļÉ£ļŗż. ļśÉĒĢ£, X65 (Cr,Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ Ļ░Ćņן ļåÆņØĆ ļČäņ£©ņØś Cr ņé░ĒÖöļ¼╝ņØ┤ ņĖĪņĀĢļÉśņŚłņ£╝ļ®░, XRD ļĪ£ ļČäņäØļÉśņ¦Ć ņĢŖļŖö ļ╣äņĀĢņ¦łņØś Cr(OH)3ņāüņØś ņÜ░ņäĖĒĢ£ ĒśĢņä▒ņØ┤ ĒÖĢņØĖļÉśņŚłļŗż.
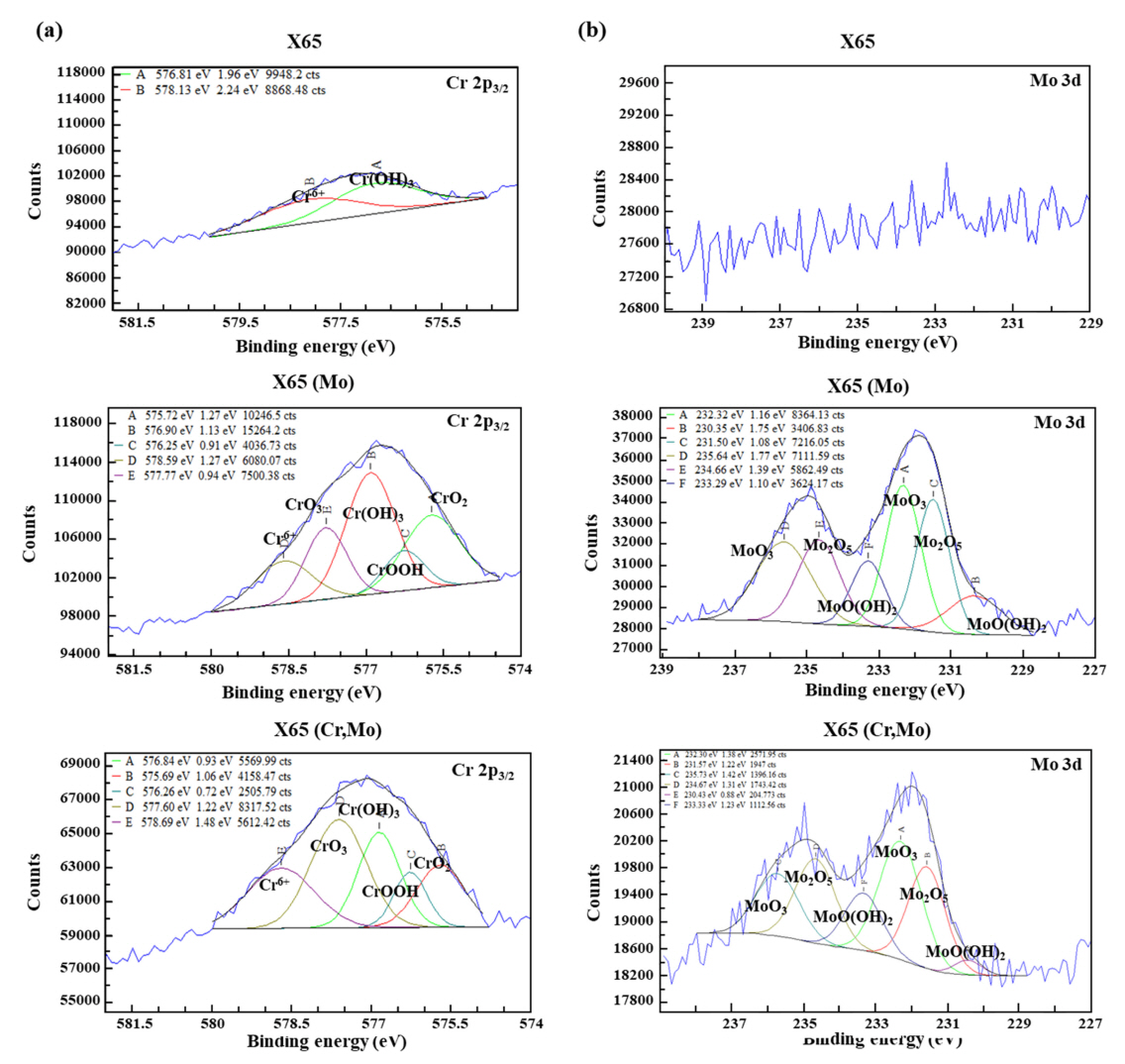
Cr (2p3/2) ĻĖ░ņżĆ ļČäņäØĻ▓░Ļ│╝ (ĻĘĖļ”╝ 13 (a)), X65 (Cr,Mo) ņŗ£ĒÄĖņØś Cr ĒĢ©ļ¤ē ņ”ØĻ░ĆļŖö ņ╣©ņ¦Ćņ┤łĻĖ░ ņżĆņĢłņĀĢņāüņØĖ CrO3ņØś ļČäņ£© ņ”ØĻ░Ćļź╝ ņĢ╝ĻĖ░ĒĢśĻ│Ā, ņØ┤Ēøä ņ╣©ņ¦Ć ņןĻĖ░ĒÖöņŚÉ ļö░ļØ╝ ļ│┤ļŗż ņĢłņĀĢņāüņØĖ Cr(OH)3ņØś ĒśĢĒā£ļĪ£ ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. Mo (3d) ĻĖ░ņżĆ Ļ▓░Ļ│╝ (ĻĘĖļ”╝ 13 (b)), Mo ļ»Ėņ▓©Ļ░Ć ņŗ£ĒÄĖņØĖ X65ņØś Ļ▓ĮņÜ░ Mo PeakņØĆ ņĀäĒśĆ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░, 0.1~0.15 wt% Mo Ļ░Ć ņ▓©Ļ░ĆļÉ£ ļŗżļźĖ ļæÉ ņŗ£ĒÄĖņŚÉņä£ļŖö PeakņØ┤ Ļ▓ĆņČ£ļÉśņŚłļŖöļŹ░, ĻĘĖ ņżæ CrņØ┤ ļ│ĄĒĢ® ņ▓©Ļ░ĆļÉ£ X65 (Cr,Mo) ņŗ£ĒÄĖ ļīĆļ╣ä X65 (Mo) ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░ ļ│┤ļŗż ļåÆņØĆ ņłśņżĆņØś IntensityĻ░Ć ļéśĒāĆļé¼ļŗż. Kermani et al. [36] ņØś ņäĀĒ¢ēļ¼ĖĒŚīņŚÉ ļö░ļź┤ļ®┤ CO2 ĒÖśĻ▓Į ļé┤Ļ░Ģņ×¼ņØś ļé┤ņŗØņä▒ Ē¢źņāüņØä ņ£äĒĢ┤ņä£ļŖö 3 wt% ņłśņżĆņØś Cr ņ▓©Ļ░ĆĻ░Ć ņÜöĻĄ¼ļÉśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ņ£╝ļ®░, 1.5 wt% Cr ņ▓©Ļ░ĆļŖö ļé┤ņŗØņä▒ Ē¢źņāüņŚÉ Ēü¼Ļ▓ī ĻĖ░ņŚ¼ĒĢśņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņ¢ĖĻĖēĒĢ£ ļ░ö ņ׳ļŗż. ļśÉĒĢ£, M. Ueda et al. [37]ļŖö 60 ~ 100 ┬░CņØś ņś©ļÅä ņĪ░Ļ▒┤ņŚÉņä£ļŖö 1 wt% ņØ┤ņāüņØś Cr ņ▓©Ļ░ĆĻ░Ć ļČĆņŗØņåŹļÅä Ļ░ÉņåīņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝ ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░, Chen et al. [38]ņØś ņŚ░ĻĄ¼Ļ▓░Ļ│╝ņŚÉņä£ļŖö 1 wt% ņłśņżĆņØś Cr ņ▓©Ļ░ĆļŖö ĻĄŁļČĆļČĆņŗØņØä ņ¢ĄņĀ£ĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņäĀĒ¢ēļ¼ĖĒŚīņØä ĒåĀļīĆļĪ£ ĒīÉļŗ©ĒĢśĻ▒┤ļīĆ, 0.4~0.5 wt% ņłśņżĆņØś Cr ņ▓©Ļ░ĆļŖö Cr(OH)3 ņé░ĒÖöļ¼╝ņØä ņŚ░ņåŹņĀüņØ┤Ļ│Ā ĻĘĀņØ╝ĒĢśĻ▓ī ĒśĢņä▒ĒĢĀ ņłś ņŚåņ£╝ļ®░, FeCO3ņÖĆņØś Ļ▓Įņ¤üņĀü ņä▒ņן ĒĢśņŚÉ ļČłĻĘĀņØ╝ĒĢ£ Ļ│äļ®┤ ĒśĢņä▒ņØä ņĢ╝ĻĖ░ĒĢśņŚ¼ ļČĆņŗØņ¢ĄņĀ£ņŚÉ ļČłņČ®ļČäĒĢ£ ņłśņżĆņØĖ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ļ░śļ®┤, X65 (Mo)ņØś Ļ▓ĮņÜ░ ņāüļīĆņĀüņ£╝ļĪ£ ņ¢ćĻ│Ā ĻĘĀņØ╝ĒĢ£ ļČĆņŗØņāØņä▒ļ¼╝ņØ┤ ĒśĢņä▒ļÉśņŚłļŗż. Mo ņ▓©Ļ░Ć Ļ░Ģņ×¼ņØś Ļ▓ĮņÜ░ ļŗżņØīņØś ņŗØ (ņŗØ (15), (16), (17))ņŚÉ ļö░ļØ╝ Mo(OH)3 ļ░Å MoO2ņØś ĒśĢņä▒ņØ┤ Ļ░ĆļŖźĒĢśļŗż. ņäĀĒ¢ēļ¼ĖĒŚīņŚÉ ļö░ļź┤ļ®┤ Ļ░Ģņ×¼ ļé┤ Mo ņ▓©Ļ░Ć ņŗ£, ņłś n m ļæÉĻ╗ś ņłśņżĆņØś Mo ņé░ĒÖöļ¼╝ (MoO2 ļ░Å MoO3)ņØ┤ ĒśĢņä▒ļÉśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļ®░, ņØ┤ļŖö Ļ░Ģņ×¼ Ēæ£ļ®┤ņØś ņ¢æĻĘ╣ņÜ®ĒĢ┤ ļ░śņØæņØä ņ¢ĄņĀ£ĒĢ©Ļ│╝ ļÅÖņŗ£ņŚÉ Ēæ£ļ®┤ņŚÉļäłņ¦Ćļź╝ Ļ░Éņåīņŗ£ņ╝£ ĻĘĖ ņāüļČĆņŚÉ ĒśĢņä▒ļÉĀ ņłś ņ׳ļŖö ļČĆĻ░ĆņĀüņØĖ ņāØņä▒ļ¼╝ņØś ĒĢĄņāØņä▒ ņśüņŚŁņ£╝ļĪ£ ņ×æņÜ®[39]ĒĢśļ®░ ļé┤ņŗØņä▒ Ē¢źņāüņŚÉ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ļśÉĒĢ£, Mo ņé░ĒÖöļ¼╝ ļ░Å Mo ņłśņé░ĒÖöļ¼╝ņØś ĒśĢņä▒ņŚÉ ņłśļ░śļÉ£ Ļ░ĆņłśļČäĒĢ┤ ļ░śņØæņØĆ ņłśņåī ļ░£ņāØņŚÉ ĻĖ░ņØĖĒĢ£ pH Ļ░Éņåīļź╝ ņĢ╝ĻĖ░ĒĢśĻ│Ā FeCO3ņØś ņ×ģņ×ÉĒü¼ĻĖ░ļź╝ Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ņØī ļśÉĒĢ£ ņČöņĖĪĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. J. N. Alhajji et al. [16]ņØś ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, Mo ņ▓©Ļ░ĆļŖö FeCO3ņØś Ļ▓░ņĀĢĒÖö ņåŹļÅäļź╝ ņ”ØĻ░Ćņŗ£Ēéżļ®░ ļé┤ņŗØņä▒ Ē¢źņāüņŚÉ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ņ£╝ļéś 0.3 wt% ņłśņżĆ ņØ┤ņāüņŚÉņä£ļŖö ĒĢ©ļ¤ēņŚÉ ļö░ļźĖ ņ░©ņØ┤Ļ░Ć Ēü¼Ļ▓ī ļéśĒāĆļéśņ¦Ć ņĢŖņØīņØä ņ¦ĆņĀüĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö MoņØś Ļ▓ĮņÜ░ 0.1 ~ 0.15 wt% ņłśņżĆņØś ļ»Ėļ¤ē ņ▓©Ļ░ĆņŚÉņä£ļÅä FeCO3ņØś Ļ▓░ņĀĢĒÖöņÖĆ Ļ│äļ®┤ ņĢłņĀĢļÅäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņ£╝ļ®░ ļé┤ņŗØņä▒ Ē¢źņāüņØä ņ£ĀļÅäĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņśĆĻ│Ā, ļ░śļ®┤ 0.4 ~ 0.5 wt% ņØ┤ĒĢśņØś ļ»Ėļ¤ēņØś Cr ņ▓©Ļ░ĆļŖö Cr(OH)3ņØś ĻĄŁļČĆ ņäØņČ£Ļ│╝ FeCO3ņÖĆņØś Ļ▓Įņ¤üņĀü ņä▒ņןņŚÉ ĻĖ░ņØĖĒĢśņŚ¼ ļČłĻĘĀņØ╝ĒĢ£ Ļ│äļ®┤ĒśĢņä▒ ļ░Å ļé┤ņŗØņä▒ ņĀĆĒĢśļź╝ ņ£Āļ░£ĒĢĀ ņłś ņ׳ņØīņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. ļŗżļ¦ī, ļ│Ė ņŗżĒŚśņØś Ļ▓ĮņÜ░ ņżæņä▒ņØś ņŚ╝ĒÖöļ¼╝ ņłśņÜ®ņĢĪ ņĪ░Ļ▒┤ņ£╝ļĪ£ ĒĢ£ņĀĢļÉśņŚłļŗżļŖö ĒĢ£Ļ│äĻ░Ć ņĪ┤ņ×¼ĒĢśļ®░ Mo ņé░ĒÖöļ¼╝ (MoO3, Mo(OH)3) ļ░Å Cr ņé░ĒÖöļ¼╝ (Cr(OH)3)ņØś ņŚ┤ņŚŁĒĢÖņĀü ņĢłņĀĢļÅäĻ░Ć ļ│ĆĒÖöļÉĀ ņłś ņ׳ļŖö pH ņĪ░Ļ▒┤ ļ░Å Autoclave ĒÖ£ņÜ®ņØä ĒåĄĒĢ£ Ļ│Āņś©/Ļ│ĀņĢĢ ņĪ░Ļ▒┤ņŚÉņä£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ņłśĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
4. Ļ▓░ ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö CO2 ĒżĒÖö ņżæņä▒ ņłśņÜ®ņĢĪ ņĪ░Ļ▒┤ņŚÉņä£ API X65ĻĖē Ļ░Ģņ×¼ļź╝ ļīĆņāüņ£╝ļĪ£ ļ»Ėļ¤ēņØś Cr ļ░Å Mo ĒĢ©ļ¤ē ļ│ĆĒÖöņŚÉ ļö░ļźĖ ļČĆņŗØĻ▒░ļÅÖņØä ļČäņäØĒĢśņśĆĻ│Ā, Ē¢źĒøä CO2 ļé┤ņŗØĻ░Ģ Ļ░£ļ░£ņØä ņ£äĒĢ£ ĒĢ®ĻĖłņäżĻ│äņØś ļ░®Ē¢źņØä ņĀ£ņŗ£ĒĢśĻ│Āņ×É ĒĢśņśĆļŗż. ņŻ╝ņÜö ņŗżĒŚś Ļ▓░Ļ│╝ļŖö ļŗżņØīĻ│╝ Ļ░ÖņØ┤ ņÜöņĢĮļÉ£ļŗż.
1. TMCPļĪ£ ņĀ£ņĪ░ļÉ£ API X65ĻĖē Ļ░Ģņ×¼ņØś ļ»ĖņäĖņĪ░ņ¦üņØĆ ļ»ĖņäĖ ĒÄśļØ╝ņØ┤ĒŖĖ ĻĖ░ņ¦Ć ļé┤ ļ»Ėļ¤ēņØś ņŗ£ļ®śĒāĆņØ┤ĒŖĖĻ░Ć ņäØņČ£ļÉ£ ņĪ░ņ¦üņØä ĒśĢņä▒ĒĢśņśĆĻ│Ā, ļ»Ėļ¤ēņØś Cr ļ░Å Mo ņ▓©Ļ░ĆņŚÉ ļö░ļźĖ Ļ▒░ņŗ£ņĀüņØĖ ņĪ░ņ¦ü ļ│ĆĒÖö ļ░Å ņĪ░ļīĆĒĢ£ ĒĢ®ĻĖł ĒāäĒÖöļ¼╝ ļō▒ņØś ņäØņČ£ņØĆ ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗż.
2. ņĀäĻĖ░ĒÖöĒĢÖņĀü ļČĆņŗØņŗżĒŚś ļ░Å ļ¼┤Ļ▓īĻ░Éļ¤ē ņĖĪņĀĢ Ļ▓░Ļ│╝ CO2 ĒżĒÖö ņŚ╝ĒÖöļ¼╝ ļé┤ ļģĖņČ£ ņ┤łĻĖ░ ļ╣ĀļźĖ ņÜ®ĒĢ┤ļ░śņØæņØ┤ ņłśļ░śļÉśļéś ņ╣©ņ¦Ć ņןĻĖ░ĒÖöņŚÉ ļö░ļØ╝ ļé┤ņŗØņä▒ņØ┤ Ē¢źņāüļÉśņŚłļŗż. ņŗ£ĒÄĖ Ļ░ä ļé┤ņŗØņä▒ ņ░©ņØ┤ļŖö X65 (Cr,Mo) > X65 > X65 (Mo) ņł£ņä£ļĪ£ ļČĆņŗØņåŹļÅäĻ░Ć ļåÆĻ▓ī ņĖĪņĀĢļÉśņŚłņ£╝ļ®░ Ļ│äļ®┤ ņĢłņĀĢļÅäĻ░Ć ļé«Ļ▓ī ļéśĒāĆļé¼ļŗż. ļČĆņŗØņāØņä▒ļ¼╝ ļČäņäØĻ▓░Ļ│╝, X65 ņŗ£ĒÄĖņŚÉņä£ļŖö FeCO3 ņāØņä▒ļ¼╝ņØ┤ ļæÉĻ╗ŹĻ▓ī ņäØņČ£ļÉśņŚłņ£╝ļ®░, ļ»Ėļ¤ēņØś Mo ņ▓©Ļ░Ć ņŗ£ĒÄĖņŚÉņä£ļŖö ļČĆņŗØ ņ┤łĻĖ░ Ļ│äļ®┤ļČĆ Mo ņé░ĒÖöļ¼╝ņØś ĒśĢņä▒Ļ│╝ ĒĢ©Ļ╗ś ņÖĖĻ░üņĖĄņŚÉ ņ¢ćņØĆ FeCO3Ļ░Ć ĒśĢņä▒ļÉśņŚłļŗż. CrĻ│╝ MoņØś ļ│ĄĒĢ® ņ▓©Ļ░Ć ņŗ£ĒÄĖņŚÉņä£ļŖö ņŻ╝ļĪ£ ļ╣äņĀĢņ¦łņØś Cr(OH)3Ļ░Ć ļé┤Ļ░üņĖĄņŚÉ ĻĄŁļČĆ ņäØņČ£ļÉśņŚłņ£╝ļ®░ ĻĘĖ ņāüļČĆņŚÉ FeCO3Ļ░Ć Ļ▓Įņ¤üņĀüņ£╝ļĪ£ ņä▒ņןĒĢśņŚ¼ ņāüļīĆņĀüņ£╝ļĪ£ ņĪ░ļīĆĒĢ£ ņ×ģņ×É ĒśĢĒā£Ļ░Ć ļéśĒāĆļé¼ļŗż.
3. Ļ▓░ĻĄŁ, CO2 ĒżĒÖö ņżæņä▒ ņłśņÜ®ņĢĪ ņĪ░Ļ▒┤ņŚÉņä£ļŖö MoņØś Ļ▓ĮņÜ░ 0.1 ~ 0.15 wt% ņłśņżĆņØś ļ»Ėļ¤ē ņ▓©Ļ░ĆņŚÉņä£ļÅä FeCO3ņØś Ļ▓░ņĀĢĒÖö ņ┤ēņ¦äĻ│╝ Ļ│äļ®┤ ņĢłņĀĢļÅä Ē¢źņāüņŚÉ ĻĖ░ņØĖĒĢśņŚ¼ ļé┤ņŗØņä▒ Ē¢źņāüņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļéś, 0.4 ~ 0.5 wt% ņłśņżĆņØś ļ»Ėļ¤ēņØś Cr ņ▓©Ļ░ĆļŖö Cr(OH)3 ņÖĆ FeCO3ņØś Ļ▓Įņ¤üņĀü ņä▒ņןĻ│╝ Ļ│äļ®┤ ļČłĻĘĀņØ╝ļÅäļź╝ ļåÆņŚ¼ ļé┤ņŗØņä▒ņØä ņśżĒ׳ļĀż ņĀĆĒĢśņŗ£Ēé¼ ņłś ņ׳ļŗż. ļö░ļØ╝ņä£, ĒāäņåīĻ░Ģ ĻĖ░ļ░śņØś Ļ▓ĮņĀ£ņĀüņØĖ CO2 ļé┤ņŗØĻ░Ģ Ļ░£ļ░£ņØä ņ£äĒĢ┤ņä£ļŖö ļ»Ėļ¤ēņØś Mo ņ▓©Ļ░ĆņÖĆ ĒĢ©Ļ╗ś Cr ĒĢ©ļ¤ē ņ”ØĻ░ĆĻ░Ć ņÜöĻĄ¼ļÉ£ļŗż. ļŗżļ¦ī, pHņØś ļ│ĆĒÖö ņĪ░Ļ▒┤ ĒĢśņŚÉņä£ Cr ņé░ĒÖöļ¼╝ ļ░Å Mo ņé░ĒÖöļ¼╝ņØś ņĢłņĀĢļÅäĻ░Ć Ēü¼Ļ▓ī ļ│ĆĒÖöļÉ©ņØä Ļ│ĀļĀżĒĢśņŚ¼, Ē¢źĒøä ĒÖśĻ▓ĮņĪ░Ļ▒┤ ļ│ĆĒÖöņŚÉ ļö░ļźĖ ļČĆņŗØĻ▒░ļÅÖ ņŚ░ĻĄ¼Ļ░Ć ņČöĻ░ĆļĪ£ ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.