1. ņä£ ļĪĀ
ļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆņØś ļīĆĒæ£ņĀüņØĖ ņ¢æĻĘ╣ņåīņ×¼ņØĖ ļ”¼ĒŖ¼ņĮöļ░£ĒŖĖņé░ĒÖöļ¼╝ņØĆ ņĮöļ░£ĒŖĖ ļ¦żņןļ¤ē ļČĆņĪ▒ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ Ļ░ĆĻ▓®ņØ┤ ļåÆņĢä Ļ▓ĮņĀ£ņĀüņØ┤ļ®░, ļīĆņ▓┤ Ļ░ĆļŖźĒĢ£ ņ¢æĻĘ╣ņåīņ×¼ļĪ£ ļŗłņ╝ł, ņĮöļ░£ĒŖĖ, ļ¦ØĻ░äņØä ĒżĒĢ©ĒĢ£ 3ņä▒ļČäĻ│ä ļ”¼ĒŖ¼ļ│ĄĒĢ®ĻĖłņåŹņé░ĒÖöļ¼╝ ņåīņ×¼ (NCM)Ļ░Ć ļäÉļ”¼ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ļŖö ļ”¼ĒŖ¼ļŗłņ╝łņé░ĒÖöļ¼╝ņØś Ļ│ĀņÜ®ļ¤ēĻ│╝ ļ”¼ĒŖ¼ņĮöļ░£ĒŖĖņé░ĒÖöļ¼╝ņØś ņĢłņĀĢĒĢ£ ņĀäĻĖ░ĒÖöĒĢÖņĀü ĒŖ╣ņä▒ ĻĘĖļ”¼Ļ│Ā ļ”¼ĒŖ¼ļ¦ØĻ░äņé░ĒÖöļ¼╝ņØś ļé«ņØĆ Ļ░ĆĻ▓® ļ░Å ņŚ┤ņĀü ņĢłņĀĢņä▒Ļ│╝ Ļ░ÖņØĆ ņןņĀÉļōżņØä ĒżĒĢ©ĒĢ£ ņÜ░ņłśĒĢ£ ņĀäĻĖ░ĒÖöĒĢÖņĀü ņä▒ņ¦łņØä ļéśĒāĆļé┤ļ®░ [1,2], ļŗżņ¢æĒĢ£ ņĪ░ņä▒ņØś 3ņä▒ļČäĻ│ä ņ¢æĻĘ╣ņåīņ×¼ļŖö ņĀäņØ┤ĻĖłņåŹĻ░äņØś ņĪ░ņä▒ ļ│ĆĒÖöļź╝ ĒåĄĒĢ£ ņĀäņ¦ĆņØś ņä▒ļŖź ņĀ£ņ¢┤Ļ░Ć Ļ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņĄ£ĻĘ╝ NCM ņåīņ×¼ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░£ļ░£ņØ┤ ĒÖ£ļ░£Ē׳ ņ¦äĒ¢ēņżæņØ┤ļŗż [3-6].
ņżæļīĆĒśĢ ņĀäņ¦ĆĻ░Ć ņé¼ņÜ®ļÉśļŖö ņĀäĻĖ░ņ×ÉļÅÖņ░© ļ░Å ņĀäļĀźņĀĆņן ņŗ£ņŖżĒģ£ņŚÉņä£ļŖö ĻĖ░ņĪ┤ņŚÉ ņé¼ņÜ®ļÉśļŹś ļ”¼ĒŖ¼ņØ┤ņ░© ĒÅÉņĀäņ¦ĆĻ░Ć ļīĆļ¤ēņ£╝ļĪ£ ļ░£ņāØĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņØ┤ļŖö ņŗ¼Ļ░üĒĢ£ ĒÖśĻ▓Įļ¼ĖņĀ£ļź╝ ņĢ╝ĻĖ░ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ĒÅÉņĀäņ¦ĆļĪ£ļČĆĒä░ ĒÜīņłśļÉ£ ņĀäņØ┤ĻĖłņåŹņØä ņ×¼ĒÖ£ņÜ®ĒĢśņŚ¼ ņ¢æĻĘ╣ņåīņ×¼ļĪ£ ņé¼ņÜ®ĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£Ē׳ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż [7]. ņ×¼ĒÖ£ņÜ®ņØä ĒåĄĒĢ£ Ni1-x-yCoxMny(OH)2ņØä ĻĖ░ļ░śņ£╝ļĪ£ ĒĢśļŖö 3ņä▒ļČäĻ│ä ņ¢æĻĘ╣ņåīņ×¼ļź╝ ĒĢ®ņä▒ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņ╣©ņČ£ Ļ│ĄņĀĢņØä Ļ▒░ņ│É ļŗ©ņØ╝ ņāüņØś ņłśņé░ĒÖöļ¼╝ ĒśĢĒā£ņØś ņĀäĻĄ¼ņ▓┤ļĪ£ Ļ│Ąņ╣© Ļ│ĄņĀĢņØä ĒĢäņłśņĀüņ£╝ļĪ£ ņØ┤ņÜ®ĒĢśļ®░, ļŗ©ņØ╝ ņä▒ļČäņØś ņłśņé░ĒÖöļ¼╝ņØ┤ ņĢäļŗī 3ņóģņØś ĻĖłņåŹ ņä▒ļČäņØś ņłśņé░ĒÖöļ¼╝ ĒśĢĒā£ņØś ĻĘĀņØ╝ĒĢ£ ņ╣©ņĀäņØ┤ ļ░£ņāØĒĢ┤ņĢ╝ ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ļź╝ ņĀ£ņ¢┤ĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. ļśÉĒĢ£ ļŗłņ╝ł, ņĮöļ░£ĒŖĖ, ļ¦ØĻ░äņØĆ ņ╣©ņĀä ņśüņŚŁņØ┤ ņä£ļĪ£ ļŗ¼ļØ╝ pH, ĻĄÉļ░ś ņåŹļÅä, ĻĖłņåŹņŚ╝ ļåŹļÅä ļīĆļ╣ä ņ░®ĒÖöņĀ£ ļåŹļÅä ļ░Å ņ░®ĒÖöņĀ£ ņóģļźś ļō▒ņŚÉ ļö░ļØ╝ Ļ│Ąņ╣© ļ░śņØæ Ēøä Ļ▓░Ļ│╝Ļ░Ć ņāüņØ┤ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļŗżņ¢æĒĢ£ ņĪ░ņä▒ņØś NCM ņĀäĻĄ¼ņ▓┤ ĒĢ®ņä▒ņØä ņ£äĒĢ£ Ļ│Ąņ╣©ļ▓ĢņØś ņĄ£ņĀüĒÖö ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż [8-12].
Ļ│Ąņ╣© ļ░śņØæņØä ĒåĄĒĢ£ ņĀäĻĄ¼ņ▓┤ ņĀ£ņĪ░ ņŗ£ ļ░śņØæĻĖ░ ļé┤ļČĆ ĒśĢņāü ļ░Å Ēü¼ĻĖ░, ļé┤ļČĆ ĒÜīņĀä Stirrer ĒśĢņāü ļ░Å ņåŹļÅä, ĒÜīņĀäļ░®Ē¢źļō▒ņØś ļ¼╝ļ”¼ņĀü Ļ│ĄņĀĢ ņØĖņ×ÉņÖĆ, ņ░®ĒÖöņĀ£ ļ░Å ĻĖłņåŹņŚ╝ņØś ļåŹļÅä ļ░Å Ēł¼ņ×ģņåŹļÅä, ļČäņ£äĻĖ░, ļ░śņØæ ņś©ļÅä ļō▒ņØś ĒÖöĒĢÖņĀü Ļ│ĄņĀĢ ņØĖņ×ÉĻ░Ć ņĪ┤ņ×¼ĒĢ£ļŗż. ņØ┤ ņżæ Ļ░Ćņן ĒĢĄņŗ¼ņĀü ņØĖņ×ÉļŖö pHļĪ£, ļ░śņØæ pHņŚÉ ļö░ļØ╝ ĒĢ®ņä▒ļÉśļŖö ņĀäĻĄ¼ņ▓┤ņØś ĒŖ╣ņä▒ņØ┤ Ļ░Ćņן Ēü░ ņśüĒ¢źņØä ļ░øļŖöļŗż. ļŗżņ¢æĒĢ£ ņĪ░ņä▒ņØś NCM ņĀäĻĄ¼ņ▓┤ ĒĢ®ņä▒ ņĄ£ņĀüĒÖöļź╝ ņ£äĒĢ£ pHņŚÉ ļīĆĒĢ£ ņśüĒ¢źņØĆ ĒāĆ ņäĀĒ¢ē ņŚ░ĻĄ¼ņŚÉņä£ ļŗżņ¢æĒĢśĻ▓ī ņłśĒ¢ēļÉśņŚłņ£╝ļ®░, ņØ┤ļź╝ ĒåĀļīĆļĪ£ ņĢöļ¬©ļŗłņĢäņłś ļåŹļÅäņŚÉ ļö░ļźĖ ņĀäĻĄ¼ņ▓┤ ņĪ░ņä▒ ļ░Å ņÜ░ņłśĒĢ£ ĻĄ¼ĒśĢĒÖöļź╝ ņ£Āņ¦ĆĒĢĀ ņłś ņ׳ļŖö ņĪ░Ļ▒┤ņØä ļÅäņČ£ĒĢśĻĖ░ ņ£äĒĢ£ ņŗżĒŚś Ļ│äĒÜŹņØä ņłśļ”ĮĒĢśņśĆļŗż [5,8-12].
ņĄ£ĻĘ╝ ņĀäĻĖ░ņ×ÉļÅÖņ░©ņØś ņŚ░ļ╣ä Ļ░£ņäĀĻ│╝ Ļ│Āņä▒ļŖźĒÖö ļ░Å Ļ│ĀņÜ®ļ¤ēĒÖö ļ¬®ņĀüņŚÉ ļ¦×ļŖö ņ¢æĻĘ╣ņåīņ×¼ Ļ░£ļ░£ņØ┤ ņÜöĻĄ¼ļÉśņ¢┤ņ¦ÉņŚÉ ļö░ļØ╝ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Ļ│ĀņÜ®ļ¤ē ĒŖ╣ņä▒ņØś Ni-Rich ņ¢æĻĘ╣ņåīņ×¼ņØĖ Li(Ni0.6Co0.2Mn0.2)O2ņØś ņĀäĻĄ¼ņ▓┤ ļ¼╝ņ¦łņØĖ 3ņøÉĻ│ä ņłśņé░ĒÖöļ¼╝(Ni0.6Co0.2Mn0.2(OH)2)ņØś ĒĢ®ņä▒ņØä ņłśĒ¢ēĒĢśņśĆņ£╝ļ®░, 3ņøÉĻ│ä ļ│ĄĒĢ® ņłśņé░ĒÖöļ¼╝ņØś ĒĢ®ņä▒ņŚÉ ņåīņÜöļÉśļŖö Ļ│ĄņĀĢ ņŗ£Ļ░ä ļŗ©ņČĢņØä ņ£äĒĢśņŚ¼ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░(LCTR, Laminar Continuous Taylor Reactor)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ NCM ņĀäĻĄ¼ņ▓┤ļź╝ ņĀ£ņĪ░ĒĢśļŖö Ļ│ĄņĀĢ ļ░®ļ▓ĢņØä ņäżĻ│äĒĢśņśĆļŗż. ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśļŖö ĒĢ®ņä▒ Ļ│ĄņĀĢ ņØ┤ņĀäņŚÉ, ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗żļź╝ ņØ┤ņÜ®ĒĢ£ Ļ│Ąņ╣© Ļ│ĄņĀĢņØä ĒåĄĒĢ£ ņĄ£ņĀüņØś ņĢöļ¬©ļŗłņĢä ļåŹļÅäļź╝ ĒÖĢļ”ĮĒĢśņśĆņ£╝ļ®░, ņØ┤ļź╝ ļ░öĒāĢņ£╝ļĪ£ ņäżĻ│äļÉ£ ņĢöļ¬©ļŗłņĢä ļåŹļÅäļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ņØś ĒģīņØ╝ļ¤¼ ĒöīļĪ£ņÜ░Ļ░Ć ĒśĢņä▒ļÉśļŖö ĻĄÉļ░ś ņåŹļÅä ļ░Å Ļ│ĄņĀĢ ņŗ£Ļ░äņŚÉ ļö░ļźĖ NCM ņĀäĻĄ¼ņ▓┤ ĒĢ®ņä▒ Ļ│ĄņĀĢņØä ņäżĻ│äĒĢśņŚ¼ ņØ┤ņŚÉ ļö░ļźĖ ņĀäĻĄ¼ņ▓┤ņØś ĻĄ¼ĒśĢĒÖöļÅä, ņ×ģņ×É Ēü¼ĻĖ░, ĻĘĀņØ╝ļÅä ļ░Å ļČäĒżļź╝ ļČäņäØĒĢśņśĆļŗż.
2. ņŗżĒŚś ļ░®ļ▓Ģ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 20 LņØś ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗żļź╝ ņØ┤ņÜ®ĒĢ£ NCM ņĀäĻĄ¼ņ▓┤ ņĀ£ņĪ░ Ļ│ĄņĀĢĻ│╝ ĒģīņØ╝ļ¤¼ ĒöīļĪ£ņÜ░ļź╝ ļ░£ņāØņŗ£ĒéżļŖö ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ņØ┤ņÜ®ĒĢ£ NCM ņĀäĻĄ¼ņ▓┤ ņĀ£ņĪ░ Ļ│ĄņĀĢņØä ņłśĒ¢ēĒĢśņśĆļŗż. Ļ░ü Ļ│ĄņĀĢņŚÉņä£ ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśļŖö ņ▒öļ▓äļŖö ņ╣Āļ¤¼ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 50 ┬░CļĪ£ ņ£Āņ¦ĆĒĢśņśĆņ£╝ļ®░, ņŗżĒŚśņŚÉ ņé¼ņÜ®ļÉ£ ņłśņé░ĒÖöĻĖ░ļŖö ņłśņé░ĒÖöļéśĒŖĖļź©(NaOH 99.9%, ļīĆņĀĢĒÖöĻĖł) Bead ĒśĢĒā£ļĪ£ļČĆĒä░ 4 M ņłśņÜ®ņĢĪņØä ņĀ£ņĪ░ĒĢśĻ│Ā, ņ░®ĒÖöņĀ£ņØĖ ņĢöļ¬©ļŗłņĢäņłś(NH4OH 28~35%, Junsei)ļź╝ 1, 2, 3 M ņÜ®ņĢĪņ£╝ļĪ£ ĒؼņäØĒĢśņśĆļŗż. ĻĖłņåŹņŚ╝ņØĆ Ni, Co, MnņØś Ļ▓ĮņÜ░ ļ¬©ļæÉ ĒÖ®ņé░ņŚ╝ņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, Ni2+ : Co2+ : Mn2+= 6 : 2 : 2 ņØś ļ¬░ ļ╣äņ£©ņØä Ļ░Ćņ¦ä 2 M ļåŹļÅäņØś ĻĖłņåŹņŚ╝ ņłśņÜ®ņĢĪņØä ņĀ£ņĪ░ĒĢśņŚ¼ ņŗżĒŚśĒĢśņśĆļŗż.
ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗żļź╝ ņØ┤ņÜ®ĒĢ£ ņŗżĒŚśņØĆ ļ╣äņ╗ż ļé┤ņŚÉ 2 M ĻĖłņåŹņŚ╝ ņłśņÜ®ņĢĪ, 4 M ņłśņé░ĒÖöļéśĒŖĖļź© ņÜ®ņĢĪ, ņĢöļ¬©ļŗłņĢäņłś ņÜ®ņĢĪņØä ļÅÖņŗ£ņŚÉ ņŻ╝ņ×ģĒĢśņśĆņ£╝ļ®░, ņĄ£ņĀüņØś ĻĘĀņØ╝ĒĢ£ ņĀäĻĄ¼ņ▓┤ ņĪ░ņä▒ ļ░Å ņÜ░ņłśĒĢ£ ĻĄ¼ĒśĢĒÖöļÅäļź╝ ņ£Āņ¦ĆĒĢśĻĖ░ ņ£äĒĢśņŚ¼ 1, 2, 3 M ļåŹļÅäņØś NH4OH ņÜ®ņĢĪĻ│╝ ĻĖłņåŹņŚ╝ ņłśņÜ®ņĢĪņØä 2 ml/minņö® Ēł¼ņ×ģĒĢśņśĆļŗż. ņłśņé░ĒÖöļéśĒŖĖļź© ņłśņÜ®ņĢĪņØĆ pH ņĀ£ņ¢┤ņŗ£ņŖżĒģ£Ļ│╝ ņŚ░ļÅÖņŗ£ņ╝£ pHĻ░Ć 10.5~11.5ļĪ£ ņ£Āņ¦ĆļÉĀ ņłś ņ׳ļÅäļĪØ ņäżņĀĢĒĢśņśĆļŗż. ĻĄÉļ░ś ņåŹļÅäļŖö 200 rpmņ£╝ļĪ£ Ļ│ĀņĀĢĒĢśņśĆņ£╝ļ®░, ņØ┤Ēøä ļČäļ¦ÉņØś ĻĄ¼ĒśĢĒÖöļÅä ļ░Å ņä▒ļČä ļČäņäØņØä ņ£äĒĢśņŚ¼ 6, 24, 48, 72ņŗ£Ļ░äļ¦łļŗż ņāśĒöīļ¦ü ļ░Å pH ņä╝ņä£ ļ│┤ņĀĢņØä ņŗżņŗ£ĒĢśņśĆļŗż.
ĻĘĖļ”╝ 1ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ņØ┤ņÜ®ĒĢ£ ņŗżĒŚśņØĆ ĒģīņØ╝ļ¤¼ ĒöīļĪ£ņÜ░ ļ░Å ņÖĆļźśņØś ļ░£ņāØ ĒÜ©ņ£©ņŚÉ ļö░ļźĖ ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ 800, 1000, 1200 rpmņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ņŻ╝ņ×ģņåŹļÅä, pH ņĀ£ņ¢┤ņŗ£ņŖżĒģ£, ņāśĒöī ņ▒äņĘ© ņŗ£Ļ░äņØĆ ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗ż ņŗżĒŚśĻ│╝ ļÅÖņØ╝ĒĢśĻ▓ī ņłśĒ¢ēĒĢśņśĆļŗż. ņĢöļ¬©ļŗłņĢäņłśņØś ļåŹļÅäļŖö ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗ż ņŗżĒŚśņØä ĒåĄĒĢśņŚ¼ ļÅäņČ£ļÉ£ ņĄ£ņĀü ņĪ░Ļ▒┤ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż.
ĒĢ®ņä▒ ņŗżĒŚśņØä ĒåĄĒĢ┤ ņ▒äņĘ©ĒĢ£ NCM ņĀäĻĄ¼ņ▓┤ļŖö ņ”ØļźśņłśļĪ£ ņäĖņ▓Ö Ēøä 80 ┬░CņŚÉ Ļ▒┤ņĪ░ĒĢ£ Ēøä ļČäņäØņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ņĀäĻĄ¼ņ▓┤ ņ×ģņ×É ĒśĢņāü ļ░Å ņĪ░ņä▒ ļČäņäØņØĆ ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į(SEM (Scanning electron microscopy), MIRA3, TESCAN)Ļ│╝ XņäĀ ĒśĢĻ┤æļČäņäØĻĖ░(XRF (X-ray fluorescence), XRF-1800, SHIMADZU)ļČäņäØ ļ░®ļ▓ĢņØä ĒåĄĒĢ┤ ņłśĒ¢ēĒĢśņśĆņ£╝ļ®░, XņäĀ ĒÜīņĀł(XRD (X-ray diffraction), XRD-6100, SHIMADZU) ļČäņäØņØä ĒåĄĒĢ┤ Ļ▓░ņĀĢ ĻĄ¼ņĪ░ņĀüņØĖ ĒŖ╣ņ¦ĢņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļČäļ¦ÉņØś ņ×ģļÅä ļČäĒż ļ░Å ĒśĢņāüņØĆ ņ×ģļÅäļČäņäØĻĖ░ (PSA (Particle size analysis) BLUEWAVE S3500, MICROTRAC)ņÖĆ SEM ļČäņäØņØä ņ¦äĒ¢ēĒĢśņśĆļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
3.1. ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗ż ņŗżĒŚśņØś ņĢöļ¬©ļŗłņĢä ļåŹļÅä ļ░Å Ļ│Ąņ╣© ļ░śņØæ ņŗ£Ļ░äņŚÉ ļö░ļźĖ NCM ņĀäĻĄ¼ņ▓┤ ņĀ£ņĪ░
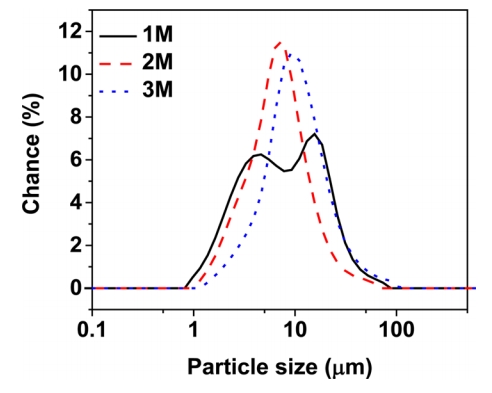
Ēæ£ 1Ļ│╝ ĻĘĖļ”╝ 2ņŚÉ ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗żļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĢöļ¬©ļŗłņĢä ļåŹļÅäņŚÉ ļö░ļØ╝ 24ņŗ£Ļ░ä ļÅÖņĢł ļ░śņØæņŗ£ņ╝£ ĒĢ®ņä▒ĒĢ£ ņĀäĻĄ¼ņ▓┤ ņ×ģņ×ÉņØś ņ×ģļÅä ļČäĒż ļ░Å D50, spanņØä ļéśĒāĆļé┤ņŚłļŗż. 1M ņØ┤ņāüņØś ņĢöļ¬©ļŗłņĢä ļåŹļÅäņŚÉņä£ļŖö ņ×ģļÅä ļČäĒżĻ░Ć ņīŹļ┤ēņØś ĒśĢĒā£ņØĖ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ĒÅēĻĘĀ ņ×ģļÅä Ēü¼ĻĖ░ļŖö ņĢöļ¬©ļŗłņĢä ļåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. D50 Ļ░ÆņØś ļ│ĆĒÖöļŖö 1 M ļåŹļÅäņØś ņ×ģļÅä ļČäĒżĻ░Ć ļ»ĖņäĖ ļČäļ¦ÉņØś 3.3 ╬╝mņØś Ēö╝Ēü¼ņÖĆ ņāüļīĆņĀüņ£╝ļĪ£ Ēü░ 16.3 ╬╝mņØś Ēö╝Ēü¼Ļ░Ć ļéśĒāĆļé©ņ£╝ļĪ£ņŹ© D50 Ļ░ÆņØ┤ 8.72 ╬╝m ņØ┤ņŚłņ£╝ļ®░, 2, 3 MņØś ļåŹļÅäņŚÉņä£ļŖö Ļ░üĻ░ü 6.22, 9.05 ╬╝mļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż.
Ļ│Ąņ╣© ļ░śņØæņŚÉ ņ░ĖņŚ¼ĒĢśļŖö ņĢöļ¬©ļŗłņĢäņłś ļåŹļÅäĻ░Ć ļé«ņØäņłśļĪØ ņĀäĻĄ¼ņ▓┤ņØś ņŗ£ļō£ ņāØņä▒ ļ╣äņ£©ņØ┤ ņĀäĻĄ¼ņ▓┤ņØś ņŗ£ļō£Ļ░Ć ņä▒ņןĒĢśļŖö ļ╣äņ£© ļīĆļ╣ä ņ”ØĻ░ĆĒĢśļ®░, ņĢöļ¬©ļŗłņĢäņłśņØś ļåŹļÅäĻ░Ć ļåÆņØäņłśļĪØ ņ┤łĻĖ░ ņŗ£ļō£ ņāØņä▒ļ│┤ļŗż ņŗ£ļō£ ņä▒ņןņØ┤ ĒÖ£ļ░£ĒĢ┤ņ¦äļŗż. ļ│Ė ņŗżĒŚś Ļ▓░Ļ│╝ņÖĆ Ļ░ÖņØ┤ 1 MņØś ņĢöļ¬©ļŗłņĢäņłśņŚÉņä£ļŖö ņ┤łĻĖ░ ņŗ£ļō£ ņāØņä▒ņØ┤ ļ╣©ļØ╝ ĒśĢņä▒ļÉ£ ļ»ĖņäĖĒĢ£ ņ×ģņ×ÉņÖĆ ĒĢ©Ļ╗ś ļ╣Āļź┤Ļ▓ī ĒśĢņä▒ļÉ£ ļ»ĖņäĖņ×ģņ×ÉļōżņØ┤ ņä▒ņןĒĢ£ ņĪ░ļīĆĒĢ£ ņ×ģņ×ÉĻ░Ć ļÅÖņŗ£ņŚÉ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ļŖö ļ»ĖņäĖĒĢ£ ņ×ģņ×ÉĻ░Ć ĒśĢņä▒ļÉ£ Ēøä Ostwald ripening ĒśäņāüņŚÉ ļö░ļØ╝ ļ»ĖņäĖĒĢ£ ņ×ģņ×ÉļōżņØ┤ ņĪ░ĻĖł ļŹö Ēü░ ņ×ģņ×ÉļōżņŚÉ ĒØĪņłśļÉśņ¢┤ ņĪ░ļīĆĒĢ£ ļČäļ¦ÉņØś ĒśĢņä▒ņØ┤ ņ¦äĒ¢ēļÉśĻĖ░ ļĢīļ¼ĖņØ┤ļ®░ [15], ņØ┤ļ¤¼ĒĢ£ ĒśäņāüņØĆ ņĢöļ¬©ļŗłņĢäņłśņØś ļåŹļÅäĻ░Ć 1 MņØ╝ Ļ▓ĮņÜ░Ļ░Ć 2, 3 MņØ╝ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢ┤ ļ╣ĀļźĖ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. 2, 3 MņØś ņĢöļ¬©ļŗłņĢä ļåŹļÅäņŚÉņä£ļŖö ņĀäĻĄ¼ņ▓┤ņØś ņŗ£ļō£ ņāØņä▒ ļ░Å ņä▒ņןņØś ņåŹļÅäĻ░Ć ņĀüņĀĢ ņłśņżĆņŚÉ ļÅäļŗ¼ĒĢ©ņŚÉ ļö░ļØ╝ ļ»ĖņäĖĒĢśĻ▒░ļéś ņĪ░ļīĆĒĢ£ ņ×ģļÅäņØś ļČäļ¦ÉņØ┤ ļÅÖņŗ£ņŚÉ ļéśĒāĆļéśņ¦Ć ņĢŖņĢśņ£╝ļ®░, D50 Ļ░ÆņØ┤ Ļ░üĻ░ü ņĢĮ 6, 9 ╬╝mļĪ£ ņłśļĀ┤ĒĢśņśĆļŗż.
ņĢöļ¬©ļŗłņĢäņłś ļåŹļÅäņŚÉ ļö░ļØ╝ ĒśĢņä▒ļÉ£ ļČäļ¦ÉņØś span Ļ░ÆņØś Ļ▓ĮņÜ░, 1M ļåŹļÅäņØś ņĢöļ¬©ļŗłņĢäņłś ņé¼ņÜ® ņŗ£ 2.95 Ļ░ÆņØä ļéśĒāĆļé┤ņ¢┤ ņāüļīĆņĀüņ£╝ļĪ£ ļäōņØĆ ņ×ģļÅä ļČäĒżļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłņ£╝ļ®░, 2, 3M ļåŹļÅäņØś ņĢöļ¬©ļŗłņĢä ņé¼ņÜ® ņŗ£ Ļ░üĻ░ü 1.90, 2.03 Ļ░ÆņØä ļéśĒāĆļāäņŚÉ ļö░ļØ╝ ņóüņØĆ ņ×ģļÅä ļČäĒżļź╝ ĒÖĢņØĖĒĢśņśĆļŗż. ļö░ļØ╝ņä£ ņĢöļ¬©ļŗłņĢäņłśņØś ļåŹļÅäļź╝ ņ”ØĻ░Ć ņŗ£Ēé┤ņ£╝ļĪ£ņŹ© ņĀäĻĄ¼ņ▓┤ņØś ĒÅēĻĘĀ ņ×ģļÅä ņ”ØļīĆĻ░Ć Ļ░ĆļŖźĒĢśĻ│Ā ņØ┤ļź╝ ĒåĄĒĢśņŚ¼ ņ¢æĻĘ╣ĒÖ£ļ¼╝ņ¦łņØś ņĀ£ņĪ░ ņŗ£ ļČäļ¦É ņ×ģļÅä ņ”ØĻ░ĆņŚÉ ļö░ļźĖ Ēæ£ļ®┤ņĀü Ļ░Éņåīļź╝ ĒåĄĒĢ┤ ņ×ģļÅä Ēæ£ļ®┤ ļ¦łņ░░ņØä Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņ¢æĻĘ╣ ĒÖ£ļ¼╝ņ¦ł ņĀ£ņĪ░ ņŗ£ ĒĢäņÜöĒĢ£ ĒāŁ ļ░ĆļÅäļź╝ ņ”ØĻ░Ć ņŗ£Ēé¼ ņłś ņ׳ļŗż.
ĻĘĖļ”╝ 3ņŚÉ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ļČäļ¦ÉņØś ņ×ģļÅä ļ│ĆĒÖöļź╝ ļéśĒāĆļé┤ņŚłļŗż. Ļ│ĄņĀĢ ņŗ£Ļ░äņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ 1 MņØś ņĢöļ¬©ļŗłņĢäņłśļź╝ ņŻ╝ņ×ģĒĢ£ ņŗżĒŚśņØĆ ļé«ņØĆ ņ×ģļÅäņØś Ēö╝Ēü¼Ļ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā, ļåÆņØĆ ņ×ģļÅäņØś Ēö╝Ēü¼Ļ░Ć Ļ░ÉņåīĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. 2, 3 M ļåŹļÅäņØś ņĢöļ¬©ļŗłņĢäņłśļź╝ ņé¼ņÜ®ĒĢ£ Ļ│ĄņĀĢņØĆ Ļ│Ąņ╣© ļ░śņØæ ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢ©ņŚÉ ļö░ļØ╝ Ēü░ ļ│ĆĒÖöļŖö ņŚåņŚłņ£╝ļéś, ĒÅēĻĘĀ ņ×ģļÅäĻ░Ć ņĢĮ 1 ╬╝m Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļéśĒāĆļé┤ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓ĮĒ¢źņØĆ ņŚ░ņåŹ Ļ│ĄņĀĢ ļ░®ņŗØņØ┤ ņĢäļŗī ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗ż ņŗżĒŚśņŚÉņä£ ļ░śņØæņØ┤ ļüØļé£ ļČäļ¦ÉļōżņØ┤ ņ¦ĆņåŹņĀüņØĖ ĻĄÉļ░śņØś ņśüĒ¢źņ£╝ļĪ£ ļČäļ¦ÉņØś ņ×ģļÅä Ļ░Éņåī ĒÜ©Ļ│╝Ļ░Ć ļéśĒāĆļé£ Ļ▓āņ£╝ļĪ£ ļ│┤ņŚ¼ņ¦Ćļ®░, 1 M ļåŹļÅäņØś ņŗżĒŚśņŚÉņä£ļŖö ņŗ£ļō£ ņāØņä▒ ļ╣äņ£©ņØ┤ ņŗ£ļō£ ņä▒ņן ļ╣äņ£©ļ│┤ļŗż ļ╣Āļ”äņŚÉ ļö░ļØ╝ ļ»ĖņäĖ ļČäļ¦ÉņØś ņ×ģļÅäĻ░Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ╗żņ¦Ćņ¦Ćļ¦ī ļ░śņØæ ņŗ£Ļ░äņØ┤ ļŗżļźĖ ļåŹļÅäņŚÉ ļ╣äĒĢ┤ ļŖÉļ”╝ņŚÉ ļö░ļØ╝ ņĄ£ņóģ ļ░śņØæ ņŗ£Ļ░äĻ╣īņ¦Ć ņĀĢņāüņāüĒā£ņŚÉ ļÅäļŗ¼ĒĢśņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ ņĢöļ¬©ļŗłņĢä ļåŹļÅäĻ░Ć 3 MņØ╝ Ļ▓ĮņÜ░ņŚÉ Ļ░Ćņן Ēü░ ņ×ģļÅäļź╝ ļéśĒāĆļé┤ņ¢┤ ņĀäņ¦Ć ņä▒ļŖźņŚÉ ņ£Āļ”¼ĒĢĀ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśņ¦Ćļ¦ī ļ¼ĖĒŚīņŚÉ ļö░ļź┤ļ®┤ 2 M ņØ┤ņāüņØś ņĢöļ¬©ļŗłņĢäļź╝ ņĀüņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ ņĀäņØ┤ĻĖłņåŹļōżņØ┤ Ļ░üĻ░üņØś ņłśĒÖöļ¼╝ ĒśĢĒā£ļĪ£ ņ╣©ņĀäļÉśļ®┤ņä£ ņāü ļČäļ”¼Ļ░Ć ņØ╝ņ¢┤ļéśĻ▓ī ļÉśņ¢┤ ņØ┤ļź╝ ĻĖ░ļ░śņ£╝ļĪ£ ĒĢśļŖö ņ¢æĻĘ╣ĒÖ£ļ¼╝ņ¦łņØś ņŚ┤ĒÖöĻ░Ć ņ┤łļלļÉśņ¢┤ ņĀäņ¦Ć ņä▒ļŖźņØ┤ Ļ░ÉņåīĒĢĀ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż [13]. ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņÖĆ ļ¼ĖĒŚīņØä ĒåĀļīĆļĪ£ ņĀäĻĄ¼ņ▓┤ ĒĢ®ņä▒ņØä ņ£äĒĢ£ ņĄ£ņĀüņØś ņĢöļ¬©ļŗłņĢäņłś ļåŹļÅäļŖö 2 Mņ×äņØä ĒÖĢņØĖĒĢśņśĆļŗż.
3.2. ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ņØś ĻĄÉļ░ś ņåŹļÅä ļ│ĆĒÖö ļ░Å Ļ│ĄņĀĢ ņŗ£Ļ░äņŚÉ ļö░ļźĖ NCM ņĀäĻĄ¼ņ▓┤ ņĀ£ņĪ░
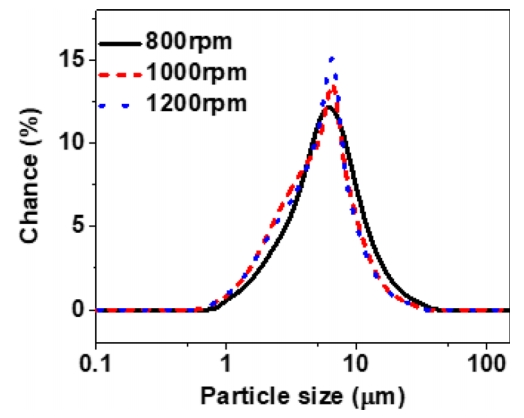
ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗żņŚÉņä£ ĒÖĢļ”ĮĒĢ£ ņĢöļ¬©ļŗłņĢäņłś ļåŹļÅäņŚÉņä£ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ņØś ĻĄÉļ░ś ņåŹļÅäĻ░Ć 800, 1000, 1200 rpmņØĖ ņĪ░Ļ▒┤ņŚÉņä£ 6ņŗ£Ļ░ä ļÅÖņĢł ņĀ£ņĪ░ļÉ£ NCM ņĀäĻĄ¼ņ▓┤ņØś ņ×ģļÅä ļČäĒżļź╝ ĻĘĖļ”╝ 4ļĪ£ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, ĒÅēĻĘĀ ņ×ģļÅä Ēü¼ĻĖ░ļŖö Ēæ£ 2ļĪ£ ņĀĢļ”¼ĒĢśņśĆļŗż. ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ņØś ĻĄÉļ░ś ņåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ĒÅēĻĘĀ ņ×ģļÅäļŖö Ļ░ÉņåīĒĢśĻ│Ā ņ×ģļÅä ļČäĒżĻ░Ć ņóüņĢäņ¦ĆļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ĻĄÉļ░ś ņåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļźĖ ĒÅēĻĘĀ ņ×ģļÅä Ļ░ÉņåīņÖĆ ņ×ģļÅä ļČäĒżĻ░Ć ņóüņĢäņ¦ĆļŖö ĒśäņāüņØĆ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ņŚÉņä£ ļ░£ņāØĒĢśļŖö ĒģīņØ╝ļ¤¼ ņÖĆļźśņŚÉ ĻĖ░ņØĖĒĢśļŖö Ļ▓āņ£╝ļĪ£, ĻĄÉļ░ś ņåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņÖĆļźś ļ░£ņāØņØ┤ ņ”ØĻ░ĆĒĢśļ®░ ļé┤ļČĆņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ļČäļ¦ÉļōżņØś ļ╣ĀļźĖ ĻĄÉļ░śņ£╝ļĪ£ ņØæņ¦æļÉśņ¢┤ ņ׳ļŖö ļČäļ¦ÉļōżņØś ņČ®ļÅīļĪ£ ņØĖĒĢ┤ ĒÅēĻĘĀ ņ×ģļÅäĻ░Ć Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ĻĘĀņØ╝ĒĢ£ ņÖĆļźśņØś ļ░£ņāØņ£╝ļĪ£ ņ×ģļÅä ļČäĒżĻ░Ć ņóüņĢäņ¦ĆļŖö ĒśäņāüņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż.
ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉ£ NCM ņĀäĻĄ¼ņ▓┤ņØś Ļ▓░ņĀĢ ĻĄ¼ņĪ░ ĒÖĢņØĖņØä ņ£äĒĢśņŚ¼ XRD ļČäņäØņØä ņ¦äĒ¢ēĒĢśņśĆĻ│Ā ņØ┤ļź╝ ĻĘĖļ”╝ 5ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. Ļ░ü ņĪ░Ļ▒┤ ļ¬©ļæÉ NCM Ļ▓░ņĀĢņāüņØä ļéśĒāĆļé┤ņŚłņ£╝ļ®░, Ļ░ü peakņØś ļ░śĻ░ĆĒÅŁ(FWHM)ņØä Ļ│äņé░ĒĢśĻ│Ā ņØ┤ļź╝ ĒåĄĒĢśņŚ¼ Scherrer ļ░®ņĀĢņŗØņŚÉ ļīĆņ×ģĒĢśņŚ¼ Ļ│äņé░ļÉ£ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ļź╝ Ēæ£ 3ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. 1000 rpm Ļ▓ĮņÜ░ Ļ░Ćņן ļ»ĖņäĖĒĢ£ Ļ▓░ņĀĢļ”Į Ēü¼ĻĖ░ņØĖ 120 nmļĪ£ Ļ│äņé░ļÉśņŚłņ£╝ļéś, ņĀäņ▓┤ņĀüņØĖ XRD ļČäņäØĻ▓░Ļ│╝ NCM Ļ▓░ņĀĢņāü ĒśĢņä▒ņŚÉļŖö Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż [16]. ņØ┤ņŚÉ ļö░ļØ╝ Ļ░ü ĻĄÉļ░ś ņåŹļÅäņŚÉņä£ ņĀ£ņĪ░ļÉ£ NCM ļČäļ¦ÉņØś ņä▒ļČä ņ░©ņØ┤ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ XRF ļČäņäØņØä ņłśĒ¢ēĒĢśņśĆņ£╝ļ®░, ņØ┤ļź╝ Ēæ£ 4ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĀ£ņĪ░ļÉ£ NCM ņĀäĻĄ¼ņ▓┤ļŖö ĻĄÉļ░ś ņåŹļÅäņØś ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ NiņØ┤ ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, MnņØĆ Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ĒåĄĒĢ£ NCM ļČäļ¦É ņĀ£ņĪ░ ņŗ£ņØś ĻĄÉļ░ś ņåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ĻĘĀņØ╝ĒĢ£ ĻĖłņåŹņŚ╝ ļåŹļÅä ĻĄ¼ļ░░Ļ░Ć ņĪ┤ņ×¼ĒĢśņŚ¼ NiĻ│╝ ņłśņé░ĒÖöĻĖ░ņØś ņĢłņĀĢņĀü Ļ▓░ĒĢ®ņØ┤ ņ£Āņ¦ĆļÉśņ¢┤ NiņØś ĒĢ©ļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ļ¬®Ēæ£ļĪ£ ĒĢśļŖö NCM ņĀäĻĄ¼ņ▓┤ņØś ņä▒ļČä ļ╣äņ£©Ļ│╝ Ļ░Ćņן ņ£Āņé¼ĒĢ£ ņĪ░ņä▒ņØĆ 1000 rpmņØś ĻĄÉļ░śņåŹļÅäņŚÉņä£ ņ¢╗ņ¢┤ņ¦ä ņĀäĻĄ¼ņ▓┤ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
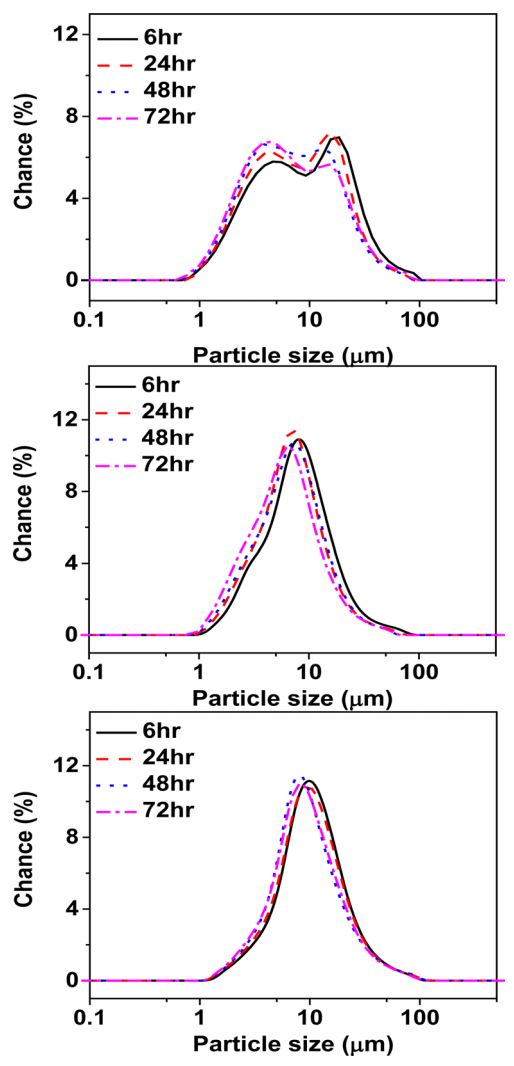
1000 rpmņØś ĻĄÉļ░ś ņåŹļÅäļĪ£ ņĀ£ņĪ░ļÉ£ ļČäļ¦ÉņØś ņŗ£Ļ░äņŚÉ ļö░ļźĖ ņ×ģļÅä ļČäĒżļź╝ ĻĘĖļ”╝ 6Ļ│╝ Ēæ£ 5ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. 6ņŗ£Ļ░ä ļ░śņØæ Ēøä ļČäļ¦ÉņØś D50 Ļ░ÆņØĆ 4.75 ╬╝m, ņØ┤ļ®░ ĒÅēĻĘĀ ņ×ģļÅä 5.31 ╬╝mļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. 24ņŗ£Ļ░äļÅÖņĢł ļ░śņØæņŗ£Ēé© ļČäļ¦ÉņØś Ļ▓ĮņÜ░ 12.09 ╬╝mļĪ£ ņ×ģļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. 6ņŗ£Ļ░ä ļ░śņØæ ņŗ£ Ēł¼ņ×ģļÉśļŖö ņÜ®ņĢĪņØś ļåŹļÅäņÖĆ ļ░śņØæĻĖ░ ļé┤ļČĆņØś ņÜ®ņĢĪņØś ļåŹļÅä ĻĄ¼ļ░░Ļ░Ć ļ░£ņāØĒĢśļ®┤ņä£ ļ╣äņĀĢņāüņāüĒā£ņØś ļČäļ¦ÉņØä ĒÜīņłśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśĻ│Ā ņØ┤ļĪ£ ņØĖĒĢśņŚ¼ 6ņŗ£Ļ░ä ļ░śņØæ ļČäļ¦ÉņØś ņ×ģļÅäĻ░Ć ņ×æņØĆ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉśļ®░, ļ░śņØæ 24ņŗ£Ļ░ä ņØ┤ĒøäņØś ļČäļ¦ÉņŚÉņä£ļŖö ļ░śņØæĻĖ░ ļé┤ņŚÉ Ēł¼ņ×ģ ļÉśļŖö ņÜ®ņĢĪņØś ļåŹļÅäĻ░Ć ņØ╝ņĀĢĒĢ£ ņĀĢņāüņāüĒā£ņŚÉ ļÅäļŗ¼ĒĢ£ ņ▒ä Ļ│Ąņ╣© ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśĻ▓ī ļÉśņ¢┤ ņØ╝ņĀĢĒĢ£ Ēü¼ĻĖ░ņØś ļČäļ¦É ņ×ģļÅäļź╝ Ļ░Ćņ¦ä ņĀäĻĄ¼ņ▓┤Ļ░Ć ņāØņä▒ļÉśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņŚ¼ņ¦äļŗż. 48, 72ņŗ£Ļ░äņŚÉņä£ ņ▒äņĘ©ĒĢ£ ņĀäĻĄ¼ņ▓┤ņØś ņ×ģļÅä Ēü¼ĻĖ░ņØś Ļ▓ĮņÜ░ Ļ░üĻ░ü 12.08, 12.11 ╬╝mļĪ£ 24ņŗ£Ļ░ä ļ░śņØæ ņŗ£ņØś ļČäļ¦ÉĻ│╝ Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
ĻĘĖļ”╝ 7ņŚÉ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ņĀäĻĄ¼ņ▓┤ņØś SEM ļČäņäØĻ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż. 6ņŗ£Ļ░äļÅÖņĢł ļ░śņØæņŗ£Ēé© ņĀäĻĄ¼ņ▓┤ļŖö ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ ļé┤ļČĆņØś ļåŹļÅäĻ░Ć ļ│ĆĒĢśĻ│Ā ņ׳ļŖö ļ╣äņĀĢņāüņāüĒā£ņŚÉ ņ׳ĻĖ░ņŚÉ ņĀäĻĄ¼ņ▓┤ ņ×ģņ×ÉļōżņØ┤ ĒĢ®ņä▒ņØ┤ ļÉśņ¢┤ļÅä ļ╣äĻĄ¼ĒśĢņ£╝ļĪ£ ņĀ£ņĪ░ ļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ĒśäņāüņØĆ ņ┤łĻĖ░ CSTR(Continuous stirred tank reactor)ņØś ļ░śņØæĻ│╝ ņ£Āņé¼ĒĢśļ®░[14], ļśÉĒĢ£ ņŚ░ņåŹņĀüņ£╝ļĪ£ ņāØņé░ļÉśņ¢┤ ļéśņśżļŖö ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņśĆņØä ļĢī, ņ┤łĻĖ░ ļ╣äņĀĢņāüņāüĒā£ņŚÉņä£ ņĀĢņāüņāüĒā£ļĪ£ ļÅäļŗ¼ĒĢśņŚ¼ ļåŹļÅä ĻĄ¼ļ░░Ļ░Ć ņØ╝ņĀĢĒĢśĻ▓ī ņ£Āņ¦ĆļÉśļŖö ņŗ£Ļ░ä ņØ┤ĒøäņŚÉ ņ¦ĆņåŹņĀüņØĖ ĻĘĀņØ╝ĒĢ£ ļåŹļÅäņØś ļ░śņØæļ¼╝ Ļ│ĄĻĖēņŚÉ ņØśĒĢ£ ļČäļ¦ÉņØś ņŚ░ņåŹ ņāØņé░ņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. 24ņŗ£Ļ░ä ļ░śņØæņŗ£Ēé© ņĀäĻĄ¼ņ▓┤ņØś Ļ▓ĮņÜ░ 6ņŗ£Ļ░ä ļ░śņØæņŗ£Ēé© ņĀäĻĄ¼ņ▓┤ ļīĆļ╣ä ĒÅēĻĘĀ ņ×ģļÅä Ēü¼ĻĖ░Ļ░Ć ņ”ØĻ░ĆĒĢśņśĆĻ│Ā ņ×ģļÅäņØś ĒśĢņāü ļśÉĒĢ£ ĻĄ¼ĒśĢņØä ļéśĒāĆļé┤ņŚłļŗż. 24ņŗ£Ļ░ä ņØ┤ĒøäņŚÉļŖö ņ×ģļÅä ļ│ĆĒÖöņÖĆ ĒśĢņāü ļ│ĆĒÖöĻ░Ć ļéśĒāĆļéśņ¦Ć ņĢŖņĢä ņĀĢņāüņāüĒā£Ļ░Ć ņ£Āņ¦ĆļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż.
4. Ļ▓░ ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗żļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĢöļ¬©ļŗłņĢä ļåŹļÅä ļ░Å ļ░śņØæ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ļČäļ¦ÉņØś ņ×ģļÅä ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢśņŚ¼ ņŚ░ņåŹ ņĀ£ņĪ░ Ļ│ĄņĀĢņØĖ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ņØś ĻĄÉļ░ś ņåŹļÅäņÖĆ ļ░śņØæ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ļ│ĆĒÖö Ļ┤Ćņ░░ņØä ĒåĄĒĢ┤ NCM ņĀäĻĄ¼ņ▓┤ņØś ņĄ£ņĀüņØś ĒĢ®ņä▒ ņĪ░Ļ▒┤ņØä ĒÖĢļ”ĮĒĢśņśĆĻ│Ā ļŗżņØīĻ│╝ Ļ░ÖņØĆ Ļ▓░ļĪĀņØä ņ¢╗ņŚłļŗż.
ņØ┤ņżæ ņ×Éņ╝ō ļ╣äņ╗żļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ░®ĒÖöņĀ£ņØĖ ņĢöļ¬©ļŗłņĢäņłśņØś ļåŹļÅäļ│ä ņŗżĒŚś Ļ▓░Ļ│╝, 2 M ņØ┤ņāüņØś ļåŹļÅäņŚÉņä£ ĻĘĀņØ╝ĒĢ£ ļČäĒżļź╝ Ļ░Ćņ¦ĆļŖö ņ×ģņ×ÉĻ░Ć ĒśĢņä▒ļÉśņŚłļŗż. 1 MņØś Ļ▓ĮņÜ░ ņŗ£ļō£ ņāØņä▒ ņåŹļÅäņØś ļ╣äņ£© ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ļé«ņØĆ ņ×ģļÅäņÖĆ ļåÆņØĆ ņ×ģļÅäņŚÉ ņīŹļ┤ēņØä ļéśĒāĆļé┤ņ¢┤ ļČäĒżĒĢśņśĆņ£╝ļ®░, 3 MņØś Ļ▓ĮņÜ░ ņ×ģļÅäĻ░Ć ņ”ØĻ░ĆĒĢśņśĆņ¦Ćļ¦ī ņāü ļČäļ”¼ļĪ£ ņØĖĒĢ£ ņĀäņ¦ĆņØś ņŚ┤ĒÖö Ļ░ĆļŖźņä▒ņØ┤ Ēü¼ļŗżĻ│Ā ĒīÉļŗ©ĒĢśņŚ¼ ņĄ£ņĀüņØś ņĢöļ¬©ļŗłņĢäņłś ļåŹļÅäļŖö 2 MļĪ£ ņäĀņĀĢĒĢśņśĆļŗż.
ņŚ░ņåŹ ņĀ£ņĪ░ Ļ│ĄņĀĢņØĖ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ░śņØæĻĖ░ņØś ĻĄÉļ░ś ņåŹļÅä ļö░ļźĖ NCM ņĀäĻĄ¼ņ▓┤ņØś ĒÅēĻĘĀ ņ×ģļÅä ļČäĒż ļ│ĆĒÖöņÖĆ Ļ▓░ņĀĢņāü ļČäņäØĻ│╝ ņä▒ļČä ļČäņäØņØä ņ¦äĒ¢ēĒĢśņśĆņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢśņŚ¼ NCM ņĀäĻĄ¼ņ▓┤ ņĀ£ņĪ░ ņŗ£ 1000 rpmņØś ĻĄÉļ░ś ņåŹļÅäņŚÉņä£ ļ¬®Ēæ£ ņĪ░ņä▒Ļ│╝ ņ£Āņé¼ĒĢ£ ņä▒ļČäņØś NCM ņĀäĻĄ¼ņ▓┤Ļ░Ć ņĀ£ņĪ░ļÉśņŚłņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ļ░śņØæ ņŗ£Ļ░äņØ┤ 24ņŗ£Ļ░ä ņØ┤ņāüņØ╝ Ļ▓ĮņÜ░ņŚÉ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ ļé┤ļČĆņØś ļåŹļÅäĻ░Ć ņØ╝ņĀĢĒĢ£ ņĀĢņāüņāüĒā£ņŚÉ ņØ┤ļź┤ļĀĆņØīņØäņ£ĀņČöĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢ┤ 24ņŗ£Ļ░äņØś ļ░śņØæ ņŗ£Ļ░ä ņØ┤ĒøäļČĆĒä░ ņŚ░ņåŹ ņāØņé░ņØ┤ Ļ░ĆļŖźĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ĒĢ£ ĒģīņØ╝ļ¤¼ ļ░śņØæĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ NCM ņĀäĻĄ¼ņ▓┤ ņĀ£ņĪ░ Ļ│ĄņĀĢņØĆ ņŚ░ņåŹņĀüņØĖ ņāØņé░ņØ┤ Ļ░ĆļŖźĒĢśļ®░, ņĀüņĀłĒĢ£ rpm ļ░Å ļ░śņØæ ņ▓┤ļźś ņŗ£Ļ░ä ņäĀņĀĢņØä ĒåĄĒĢśņŚ¼ ĻĖ░ņĪ┤ ĻĄÉļ░ś ļ░śņØæĻĖ░ļź╝ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ ļīĆļ╣ä ĻĄÉļ░ś ņŗ£Ļ░ä ļŗ©ņČĢ ļ░Å ņŚ░ņåŹ ņāØņé░ņØ┤ Ļ░ĆļŖźĒĢĀ Ļ▓āņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ļ│┤ļŗż Ļ▓ĮņĀ£ņĀüņØ┤Ļ│Ā ĒÜ©ņ£©ņĀüņØĖ ļ░®ļ▓ĢņØ┤ ļÉĀ Ļ▓āņ£╝ļĪ£ ņĀäļ¦ØļÉ£ļŗż.