금속 산화물 지지체를 이용한 산소환원반응에 대한 전기화학 촉매 연구 동향
Review of Electro-catalysts Supported by Metal Oxides for Electrochemical Oxygen Reduction Reaction
Article information
Trans Abstract
Global warming and air pollution have forced greater attention to new energy sources to replace fossil fuels. Among several eco-friendly energy sources, polymer electrolyte membrane fuel cells have been increasingly investigated since they have zero emissions, high energy density, and high energy efficiency. Carbon-supported Pt catalyst is generally used for the cathodic catalyst in polymer electrolyte membrane fuel cells. However, Pt/C catalysts corrode under start-up/shut-down conditions. Pt agglomeration, separation, and loss can occur due to the carbon corrosion, which results in a rapid performance loss. Metal oxide is a promising candidate as an alternative support since it shows high stability in the high potential. Of several metal oxides, titanium oxides and tin oxides have been widely investigated. Their performance is comparable to the Pt/C catalyst, and they have shown even higher durability than the Pt/C catalyst in accelerated stress tests simulating start-up/shut-down conditions. In this paper, we summarize the development of metal oxide supports for the Pt catalyst in the five most recent years. In recent studies, the characteristics of metal oxides have been varied using new synthesis methods, annealing temperature, precursors, and dopants, which results in enhanced ORR activity and durability. Advanced metal oxides have shown high durability and exhibited acceptable performance compared to the state-of-the-art Pt/C catalysts.
1. 서 론
현재 전 세계 에너지 생산은 화석 연료 기반 에너지원에 의해 유지되고 있다. 증가하는 에너지 사용량과 더불어 급증한 화석 연료 사용으로 인해 환경오염 문제가 심각하여 친환경 에너지에 대한 필요성이 관심을 받고 있다[1,2,3]. 연료전지(Fuel cells)은 전기 화학 반응을 통해 화학 에너지를 전기 에너지로 변환하는 에너지 변환 반응기이다[4,5]. 연료전지는 전기와 함께 물 또는 열만 배출하여 친환경적이며 높은 효율을 갖는 장점을 가지고 있어 유망한 에너지 변환 장치이다[6]. 현재 연료전지의 높은 생산 비용과 낮은 내구성으로 인해 상업화가 늦어 지고 있다[7,8]. 합리적인 금속 촉매와 지지체를 설계하는 것은 과전압을 낮추어 에너지 변환 효율을 높이는데 중요하다.
특히 전기 화학 촉매 지지체는 입자크기, 비표면적 등의 물리적 특성과 촉매 안정성, 활성 등의 전기화학적 특성에 큰 영향을 미친다[9]. 탄소 지지체는 Pt을 담지하기 위해 가장 널리 사용되는 지지체이다[10-13]. 탄소 지지체와 Pt 사이의 상호작용은 Pt/C 촉매에 중요한 역할을 한다. 개질을 통해 탄소 지지체에 결함 및 작용기 등을 생성하고 Pt입자와의 강한 화학적 결합을 유도한다. 탄소는 (1) 우수한 전기전도성과 (2) 넓은 비표면적, (3) 산성 및 염기성에서 높은 안정성, (4) 저렴한 비용, (5) 기공 구조 조절 등의 장점을 갖는다[14-17]. 하지만 Pt/C 촉매는 연료전지의 시동/정지 시 발생하는 높은 potential로 인해 탄소 부식 현상을 겪는다[18]. 탄소 지지체가 부식되면 Pt 입자와 탄소 지지체 사이의 상호작용이 약해져 지지체에서 Pt 응집, 분리, 손실 등의 문제를 일으킨다[19-21]. 이는 전기화학적 활성 표면적(electrochemical surface area, ECSA) 의 감소로 이어져 연료전지의 내구성을 저하시킨다[22-25].
따라서 연료전지의 내구성과 활성을 높이기 위해서 더 안정적인 지지체 물질의 개발이 필수적이다. 이상적인 지지체는 (1) 우수한 전기전도성 (2) 촉매-지지체 간의 상호 작용 (3) 넓은 비표면적 (4) 높은 내식성 (5) 열과 전기화학적 안정성 등을 필요로 한다[26]. 안정적인 지지체를 개발하기 위한 많은 연구가 진행되고 있으며 탄화물, 질화물, 유무기 하이브리드와 같은 다양한 비탄소 지지체 재료가 주목받고 있다[27,28]. 그 중 금속 산화물(metal oxides, MO) 지지체는 탄소보다 우수한 기계적 강도, 부식 저항 등 다양한 운전 조건에서 탄소보다 높은 안정성을 갖는다[29-31]. 특히 MO 지지체의 높은 산화 안정성으로 인해 강한 부식 저항을 보이며 금속 촉매 나노 입자와 MO 지지체 사이의 strong metal support interaction(SMSI)로 인해 금속 나노 입자의 구조를 안정화 시킨다[32-36]. 이와 같은 장점들 때문에 MO를 이용한 지지체가 탄소 지지체의 단점을 보완하고 대체하기 위한 연구가 진행 중이다. 특히 TiO2, SnO2, WO2 등이 활발하게 연구되고 있다.
본 논문에서는 최근 보고된 산소 환원 반응(oxygen reduction reaction, ORR)을 위한 MO 지지체와 관련된 논문들을 요약 정리하였다. 이를 통해 MO 지지체의 합성과 개질에 따라 촉매의 성능 변화를 알아보고 전기 전도도 향상과 비표면적 증가를 위한 합성 전략 및 물성 변화가 미치는 영향에 대해 알아보았다.
2. 본 론
2.1 Titanium oxide 지지체
Titanium oxide (TiO2)는 산성 및 염기성 매질에서 높은 부식 저항, 전기화학적 안정성, 저렴한 비용, SMSI, 촉매 성능을 향상시키는 hypo-d-electron 특성을 갖는 유망한 촉매 지지체이다[37-41]. 또한 Pt 나노 입자와 강한 시너지 효과로 인해 촉매 특성을 향상시킨다[42]. 위와 같은 독특한 장점으로 인해 TiO2는 전기화학적 에너지 변환 및 저장 시스템에서 많은 관심을 받고 있다. 이에 반해, TiO2는 넓은 밴드갭(Eg = 3.2 eV)때문에 전기 전도도가 매우 낮아 전기 화학 촉매 지지체로서 한계점을 보인다[43-45].
2.1.1 TiO2의 구조
TiO2 지지체의 구조를 조절한 연구 결과를 찾아볼 수 있다. 3차원 성게 모양의 다공성 TiO2 hollow sphere(UMTHS)를 수열합성법으로 합성한 후, 이를 지지체로 사용하여 Pt 나노 입자를 균일하게 담지한 촉매의 ORR 활성이 보고되었다[46]. 3차원 나노 TiO2는 높은 비표면적(167.1 m2 g−1)으로 인해 전하 이동에 유리하며 Pt/UMTHS의 전자 이동 수는 3.86~3.94 였다. 향상된 ORR 활성과 낮은 mass activity 손실을 나타냈으며, 이는 Pt과 지지체 사이의 SMSI 현상으로 인해 향상된 내구성을 나타낼 수 있었다. Naik 그룹은 수열합성법을 이용해 합성한 anatase상의 TiO2 nanosheet (anatase-TiO2 NS)를 지지체로 사용한 Pt 담지 촉매를 ORR에 적용하였다[47]. 연구자들은 anatase-TiO2 NS를 합성한 후, NaBH4 용액을 이용해 anatase-TiO2-x NS로 환원시켰다. 환원에 의해 TiO2에 산소결손이 생겨 표면결함을 형성하였으며 이는 밴드갭 수축을 유발하였다. Ti의 산화도가 Ti4+에서 Ti3+로 부분환원되었고, 그로 인해 TiO2-x NS의 밴드갭은 2.56 eV로 가장 작았다. 또한 NS 구조의 지지체는 얇은 촉매 지지층을 제공하고 촉매층 내에게 물질 전달을 개선하여 ORR 활성을 향상시켰다. Pt/TiO2 촉매를 수소에서 200 °C로 열처리 하고 불산처리에 의해 적절한 지지체 합성과 성능 향상을 이끌 수 있다[48]. 고온 열처리를 하면 TiO2가 환원되어 활성 부위를 가려 성능이 저하될 수 있다. 그들은 고해상도 투과전자현미경과 X선 광전자 분광법을 통해 산화물 층은 확인했다. 환원된 Pt/TiO2-x 촉매 표면에 형성된 층은 OHad가 활성 Pt에 접근하는 것을 방해하여 ORR을 감소시킨다. 이 문제를 해결하기 위해 불산으로 산화물 층을 제거하였으며 OHad가 활성 Pt에 접근하기 용이하게 유도하여 ORR 활성과 안정성이 향상되었다. 입자크기(5, 18, 30 nm)와 Pt함량(6, 12, 37 wt%)이 Pt/TiO2촉매의 ORR 활성과 안정성에 미치는 영향이 보고되었다[49]. 연구자들은 투과전자현미경을 통해 TiO2 입자크기가 작을수록 표면 핵 형성 사이트가 풍부한 것을 확인하였다. CO-stripping voltammetry에 의해 지지체의 입자크기가 증가할수록 ECSA가 증가하는 것을 확인하였다. 이는 지지체 입자크기가 클수록 담지되는 Pt의 양이 많아지기 때문이다. Pt 함량은 높아질수록 개시전위는 향상되었지만 가속 내구성 테스트 후 ECSA와 ORR 활성 손실은 증가하였다. 이를 근거로 연구자들은 최적의 Pt 함량은 12 wt%라고 주장하였다.
2.1.2 도핑된 TiO2
TiO2의 높은 밴드갭에 의한 단점을 극복하기 위해 금속 및 비금속 원소로 TiO2에 도핑하거나 유기 화합물을 이용한 복합재료 합성 연구가 많이 보고되었다. TiO2에 도핑을 하면 TiO2 표면에 산소 결손이 생겨 TiO2의 밴드갭을 줄이고, 페르미 준위 아래로 상태밀도를 높일 수 있기 때문에 전기전도도를 향상시킬 수 있으며, 전기화학적 성능에 긍정적인 영향을 미친다[50,51]. 따라서 Nb, Ta 또는 V 같은 n형 도펀트를 사용하여 TiO2에 도핑하여 산소 결손을 생성해야 한다[52,53]. TiO2는 불충분한 기공구조와 구형 형태로 인해 낮은 비표면적을 갖는다. 낮은 비표면적은 Pt 입자의 균일한 분산을 방해한다[46]. 적절한 도펀트의 선택은 이와 같은 낮은 비표면적을 갖는 TiO2의 단점을 극복하고 넓은 비표면적을 구현할 수 있고 촉매 표면의 활성 부위를 증가시킨다[54].
Yu 그룹은 solvothermal 방법을 통해 코발트를 도핑한 TiO2 NS assembles (Ti0.8Co0.2O2 NTA)를 합성하여 Pt 입자를 담지 하였다[55]. Co의 도핑 농도가 증가함(25%>x)에 따라 표면에 있는 Pt d-band center가 음의 방향으로 이동하였다. 이는 Pt와 중간 산화물 사이의 상호작용을 최적화시켜 향상된 ORR 활성을 보였다. 또한 지지체의 독특한 계층 구조와 다공성 구조는 촉매에 효율적인 물질전달을 유도하고 활성 부위와 전해질 사이의 상호작용을 통해 증진된 반응 속도를 달성하였다. 촉매 활성을 향상시키기 위해 형태를 조절하며 Nb을 도핑한 TiO2 nanotube 지지체를 합성하여 Pt에 담지해 Pt/Nb-TiO2 nanotube를 평가하였다[56]. 0.4–1.0 V (vs. RHE)에서 4000 사이클 동안 가속 내구성 테스트 후에 상용 Pt/C의 mass activity는 64% 감소한 반면 6 wt% Pt/Nb-TiO2의 경우 31% 감소하였다. 합성된 촉매는 균일한 Pt 입자 크기로 인한 표면결함이 감소하였고, 이는 Pt 표면의 산소 종의 흡착 강도를 증가시켜 전기화학적 안정성 및 ORR활성을 향상시킨다. Esfahani 그룹은 산성에서 안정하고 전자 전도체(electronic conductor)의 특징을 갖는 몰리브데넘을 도핑한 아산화티타늄 나노튜브를 합성하여 백금에 담지하였다[57]. X선 광전자 분광법을 통해 Pt 4f7/2에 해당하는 결합 에너지가 Pt/C와 비교하여 더 높은 값을 가짐으로서 TNTS-Mo(Modoped titanium nanotubes suboxide)에서 Pt로의 전자이동이 있음을 알 수있으며 이는 ORR활성을 향상시킨다. 또한 지지체 표면에 OH 또는 O의 측면의 반발력(lateral repulsion)에 의해 Pt 표면에 흡착된 OH의 환원은 ORR활성과 안정성 향상에 기여한다. Hornberger 그룹은 구조적 안정성이 우수한 ruthenium–titanium mixed oxide (RTO)를 합성하여 Pt 나노 입자를 담지하여 high-energy x-ray diffraction (HE-XRD)와 scanning flow cell을 이용한 유도쌍 플라스마 질량 분석 및 성능 평가를 수행하였다[58]. 높은 안정성에도 불구하고 가속 내구성 테스트 동안 촉매 반응 속도를 열화시키는 원인으로 Pt 표면의 피독 현상을 관찰하였다. SMSI로 인해 Pt 표면에 얇은 산화물 층이 성장하여 산화물 지지체를 이용한 Pt 촉매의 성능을 저하시킨다. Pt 나노입자의 크기와 분산의 자발적 변화를 확인하기 위해 다양한 전이금속을 사용하여 TiO2 nanotube(M-TiO2, M = V, Nb, Cr)를 합성하고 그에 따른 영향을 보고하였다[59]. 각 지지체에는 동일한 비율의 Pt을 담지했다. 도핑 금속이 달라짐에 따라 Pt/M-TiO2 나노튜브에서 Pt 나노 입자의 자발적인 크기, 분포, 에너지 특성이 변하였다. 그 중 Pt의 d-spacing 값이 가장 작은 Pt/V-TiO2 촉매(3.9083 Å)는 격자 수축에 의해 Pt 나노 입자의 분산도가 높고, 3.2 nm의 작은 평균 입자 크기를 보였다. 그 결과 높은 ORR활성과 내구성을 보였다. Nb 도핑과 환원 분위기에서 열처리는 TiO2 nanofiber (TNF)의 섬유 직경, 입자크기, 산소 결손, 전기 전도도에 긍정적인 영향을 미쳤다. 650 °C와 800 °C에서 5% H2/Ar 분위기에서 열처리하여 Nb-TNF을 합성하였다[52]. 800 °C에서 열처리한 Nb-TNF800의 전기 전도도가 가장 높았으며 이로 인해 Pt/Nb-TNF800의 ECSA는 48 m2 g−1였다. Pt/C의 ECSA(42 m2 g−1)와 비교했을 때 향상된 특성을 보였다. 이는 anatase상에서 rutile 상으로의 전환과 Ti4+가 Ti3+로, Nb5+가 Nb4+로 환원되었기 때문이다. Anwar 그룹은 나노 크기의 Ta이 도핑된 TiO2을 400–1000 °C의 다른 온도에서 열처리를 한 연구에서 800 °C에서 열처리를 한 Pt/Ta-TiO2 촉매의 활성이 가장 우수했다[60]. 열처리 온도가 800 °C 이상일 때, anatase에서 rutile상으로 변화하며, rutile상으로의 변화에 따른 anatase상의 억제는 Ti의 결정 격자에서 Ta이 치환되어 통합됨을 의미한다. 이러한 상 변화는 시너지 효과를 가져오며 원자가와 전도대 사이의 전자 구조를 변경시킬 뿐만 아니라 Ti에 산소 결손이 생겨 전기 전도도를 향상시킨다.
2.1.3 탄소 복합 TiO2
촉매 성능을 향상시키기 위해 탄소-MO 복합 지지체에 Pt 입자를 담지한 촉매를 개발하는 연구들도 활발히 이루어졌다. Ji 그룹은 전기 전도도를 향상시키고 전자 구조를 개선하기 위해 Pt/TiO2 nanofiber에 carbon nanotube(CNT)를 감아 CNT-Pt/TiO2를 합성하였다[61]. 이로 인해 Pt의 d-state는 TiO2 전자와 CNT의 추가적인 전자에 의해 활성이 향상된다. 또한 Pt 입자의 화학구조는 TiO2 표면에 접촉한 CNT에 의해 상대적으로 높은 활성으로 변화하였다. 이로 인해 제한 전류 밀도가 상용 Pt/C 촉매에 비해 40% 더 향상되었다. 그래핀과 TiO2에 각각 질소로 도핑한 NG-TiON hybrid 지지체에 Pt을 담지한 연구도 있었다[62]. Pt/NG-TiON 촉매의 향상된 ORR 활성과 ECSA는 이중 질소 도핑으로 인해 전기전도도와 전자이동이 증가했다. 특히 X선 광전자 분광법을 통해 그래핀에 pyridinic-N 형태로 도핑됨을 알 수 있었으며 이는 ORR에 대한 활성 부위를 생성하여 ORR 활성을 개선시켰다. Wei 그룹은 전도성이 좋은 TiN을 염기 처리하여 TiN 일부를 TiO2로 변형시켜 TiN-TiO2 지지체를 합성해 Pt에 담지하였다[63]. 내구성 테스트 후에 Pt/C의 ECSA는 82% 감소하였지만 Pt/TiN-TiO2는 62% 감소하여 높은 안정성을 보였다. 이는 TiO2의 높은 내산화성 때문에 촉매의 내구성이 향상되었다.
2.2 Tin oxide 지지체
SnO2는 산화촉매 및 전도체로 응용되는 금속 산화물 중 하나이다. SnO2는 넓은 밴드갭(Eg = 3.6 eV)을 갖기 때문에 전기전도성이 매우 낮아 촉매 활성이 낮다[64,65]. 전도성을 증가시키기 위해 SnO2는 탄소와 복합체로 이용되어 지지체의 전도성을 보존하는 보호층으로 사용되거나 전하 운반체로서 여분의 전자를 제공하는 Nb, Sn을 포함한 5가 이온으로 n-도핑된다[66,67]. n형 도펀트는 자유 전자 농도를 증가시키고 SnO2의 전도대 근처에서 페르미 준위를 상향 이동시켜 전기전도도를 높인다[67]. SnO2 지지체는 일반적으로 SnCl4를 전구체로 사용하며, 그 외에도 SnC2O4, Sn(C7H15COO)4 등을 전구체로 이용하는 연구들이 보고되었다.
Fabbri 그룹은 두개의 Sn 전구체(SnCl4와 SnC2O4)와 폴리스티렌(PS) microspheres의 질량비를 변화하여 SnO2를 합성하였다[68]. Sn과 PS의 질량비는 SnO2의 다공성구조, 형태, 상 조성을 변화시켰으며 PS 함량과 열처리 시간을 증가시키면 전기 전도도 및 안정성이 향상되었다. 또한 SnCl4보다 SnC2O4를 전구체로 사용하여 합성한 SnO2의 전기 전도도가 높았다. 이는 SnC2O4를 사용한 SnO2는 길고 매끄러운 표면을 가진 반면에 SnCl4를 사용한 SnO2샘플은 느슨한 형태를 가져 전자 전달이 어려울 것이라고 주장했다. Chao 그룹은 향상된 ORR활성과 내구성을 향상시키기 위해 Pt/SnO2 이종접합을 합성해 Pt의 전자 구조를 개질하였다[69]. X선 광전자 분광법을 통해 Pt/SnO2의 Pt 4f7/2 및 Pt 4f5/2 피크가 상용 Pt/C와 비교하여 0.70 eV 음의 이동을 보였다. 이는 SnO2에 지지된 Pt 나노입자가 탄소에 지지된 Pt 나노입자보다 더 높은 전자 밀도를 가짐을 알 수 있다. 높은 전자밀도는 Pt와 SnO2 사이에 강한 상호작용을 유도하고 향상된 tafel slope과 반파장 전위를 확인할 수 있다. 20 − 80 °C의 전해질 온도에 따른 Pt/Nb-SnO2의 ORR 활성을 비교한 연구에서는 전해질온도가 증가함에 따라 ORR에 대한 겉보기 상수(kapp)가 증가하였다[70]. 80 °C에서 kapp는 모든 촉매에 대해 20 °C에서 보다 약 3−4배 높았다. Pt 함량이 증가할 때 (111)면이 우선적으로 성장하며 나노로드를 형성하려는 경향이 있다고 주장했다. 또한 Pt/Nb-SnO2 촉매는 내구성이 뛰어나 가속 내구성 테스트 후에도 우수한 활성을 유지한다. 낮은 도핑 수준에서 일부 Sn4+ 이온은 Sb5+ 이온으로 대체되어 더 많은 전도 전자를 생성하여 전기 전도도를 증가시킨다[71]. 그러나 4−5 at%를 초과하면 Sb5+이온이 표면으로 분리되어 Sb3+로 환원된다. 표면에 산소결핍이 있기 때문에 이러한 Sb3+은 Sn2+을 대체하여 전기 전도도를 증가시킨다. ORR에서 Pt 함침량에 따른 성능을 비교한 연구도 보고되었다. Pt 함침량이 17.4 wt%에서 34.2 wt%로 증가하면 각 온도에서 ORR 성능이 2−3배 증가하였다. 이는 Pt의 함침량이 증가함에 따라 Pt 입자의 형성이 O2 흡착을 위한 활성 부위를 노출시키기 때문이다[70]. 반면 Pt/1Ta/SnO2 촉매의 경우는 지지체의 낮은 표면적에 비해 높은 Pt 로딩으로 촉매의 응집이 강화되어 촉매와 지지체의 불완전한 전기적 접촉이 나타난다. 이는 활성점의 수와 ECSA, 제한전류밀도를 감소시킨다[72]. 도펀트인 TaCl5의 함량에 따른 SnO2촉매의 ORR에 대한 연구도 있었다[72]. 도펀트의 함량은 전기전도도와 비표면적에 영향을 준다. 도펀트의 함량이 높을수록 비표면적은 증가하는 반면 전기전도도는 1 at%에서 가장 높았지만 함량이 증가할수록 점점 낮아졌다. 이는 제한된 도펀트 용해도와 도펀트 농도가 증가함에 따라 도너 상태를 낮추는 Jahn-Teller 격자왜곡 때문이다. sol-gel 방법을 사용하여 Sb-SnO2 (ATO, Antimony doped tin oxide) 에어로졸을 합성하였다[73]. Sb 함량이 10 at%일 때 최적의 비표면적과 전기전도도 값을 보였다. 또한 Pt/10 at% Sb-SnO2는 Pt/C보다 ORR 활성이 2배 향상되었다. 그러나 가속 내구성 테스트 후에 Sb원자는 손실되어 Sb이 부족한 쉘의 모양을 나타냈다. Sb-SnO2 표면에서 Sb원자가 손실되면서 Pt 나노입자와 지지체의 전자를 교환하는 능력이 감소되며 ORR에 대한 촉매활성을 감소시켰다. 열처리와 도핑함량이 Sb-SnO2 지지체의 전기 전도도에 미치는 영향에 대한 연구가 있었다. Sb-SnO2 지지체는 합성 후 열처리 온도를 400−700 °C로 조정하였다[74]. Sb-SnO2의 최대 전도도는 600 °C에서 관찰되었지만 500−600 °C 사이에서 비표면적은 절반이 감소하였다. 이로 인해 연구자들은 최적의 열처리 온도는 550 °C라고 주장하였다. 열처리 동안 Sb-SnO2의 Sb(III) 이온이 Sb(V) 이온으로 산화된다. n형 도펀트인 Sb(V) 이온의 존재는 더 많은 결함을 생성하여 Sb-SnO2의 전기전도도를 증가시킨다. 하지만 열처리를 거친 Pt/Sb-SnO2 촉매의 ECSA (84 m2 gPt −1)는 Pt 입자 크기 증가로 인해 열처리를 하지 않은 Pt/Sb-SnO2 촉매의 ECSA (95 m2gPt −1)에 비해 감소하였다. 도펀트 원소와 함량은 SnO2 결정 구조와 전기 전도도에 상당한 영향을 미친다. Mohanta 연구팀은 Sb의 도핑 함량을 0.25 – 8 at%로 조정하였다. Sb-SnO2의 전기 전도도는 Sb 도핑에 따라 5 at%까지 증가하다가 다시 감소하며, 5 at% 도핑에서 최대 전자전도도를 보였다. Fabbri 연구팀은 도펀트와 도핑함량을 변경하며 M-SnO2 (M= Nb, Sb, W, Ta)지지체를 Pt에 담지한 후 ORR 활성을 보고하였다[75]. 모든 샘플의 ORR 활성을 비교하였을 때 ORR 활성은 전기전도도, Pt-O 환원피크전위((EPt-O_red)와 뚜렷한 경향성이 없었다. 낮은 전기전도도를 갖는 SnO2로 인해 Pt 나노입자에 대한 낮은 ORR 활성을 유도하지만 특정 임계값(x > 10 S cm−1) 이상에서는 전기전도도가 더 이상 ORR 활성을 결정하지 않는다는 것을 알 수 있다. 촉매 중 Pt/1.7 at% Nb-SnO2, Pt/2.1 at% W-SnO2 ORR 활성(0.9 V vs. RHE)은 Pt/C에 비해 2배 높았다. He 연구팀은 지지체 표면에 Pt anchor site를 생성하도록 설계된 에어로졸 합성을 통해 Sb-SnO2 지지체를 합성하여 Pt에 담지한 Pt/Pt-aerogel-ATO 촉매를 보고했다[76]. ATO 에어로졸은 상대적으로 높은 비표면적과 다공성 구조를 가지며 700 °C에서 열처리하면 x ≥ 0.2 S cm−1의 전기 전도도를 갖는다. X선 광전자 분광법을 통해 Pt/Pt-aerogel-ATO는 대부분 Pt(0)이었지만 Pt/aerogel-ATO는 Pt 산화 상태인 Pt(II) 및 Pt(IV)로 담지되어 있음을 밝혔다. 이를 통해 Pt anchor site가 Pt 환원을 촉진하여 촉매 활성과 내구성을 향상시킴을 알 수 있다. 전통적인 증착법과는 다른 증착법을 이용하여 Pt를 담지한 연구도 있었다[77]. Sb-SnO2에 Pt을 원자층증착(atomic layer deposition, ALD)을 이용하여 ALD-Pt/ATO를 합성하였다. 화학적 환원법으로 합성한 Pt 촉매의 전기 전도도는 ALD-Pt/ATO촉매에 비해 매우 낮았다. 이는 환원 과정에서 Sb(V)가 Sb(III)로 전환되어 수용체 부위가 형성되고 동시에 carriers가 손실되어 전기전도도가 손실된다. 따라서 ALD-Pt/ATO는 다른 촉매에 비해 활성과 ECSA가 높았지만 Sb용해 및 재증착이 발행하여 ALD-Pt/ATO 성능을 저하시켰다. 이러한 문제를 해결하기 위해 다양한 도핑 원소를 SnO2에 도핑한 M-SnO2 nanotube (M=Sb, Nb, In, F, S)를 Pt 촉매의 내식성에 대해 보고한 연구도 있었다[78]. AST 후 양이온으로 도핑 된 SnO2 (Nb-SnO2, In-SnO2, Sb-SnO2)의 경우 음이온으로 도핑된 F-SnO2에 비해 훨씬 많은 양의 원소가 용해되었음을 유도결합플라즈마 분석기를 통해 확인했다. 이는 양이온으로 도핑하는 경우, Sn은 Sb, Nb로 대체되는데 비해 F-SnO2의 경우 O를 F로 대체하여 SnO2에 잘 결합되기 때문이다. 다양한 도핑 원소 중 SnO2에 도핑된 불소 음이온은 전기전도도를 향상시키고 전기화학적 용해과정을 억제하는 착화제와 유사한 구조를 형성하여 전기화학적 내구성을 향상시킨다.
2.3. 그 외의 metal oxide
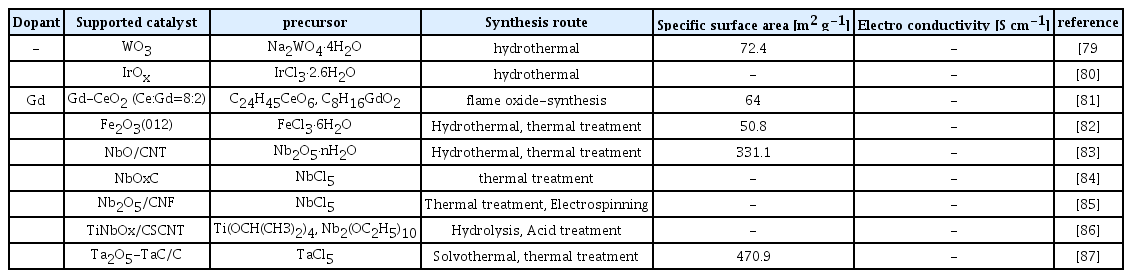
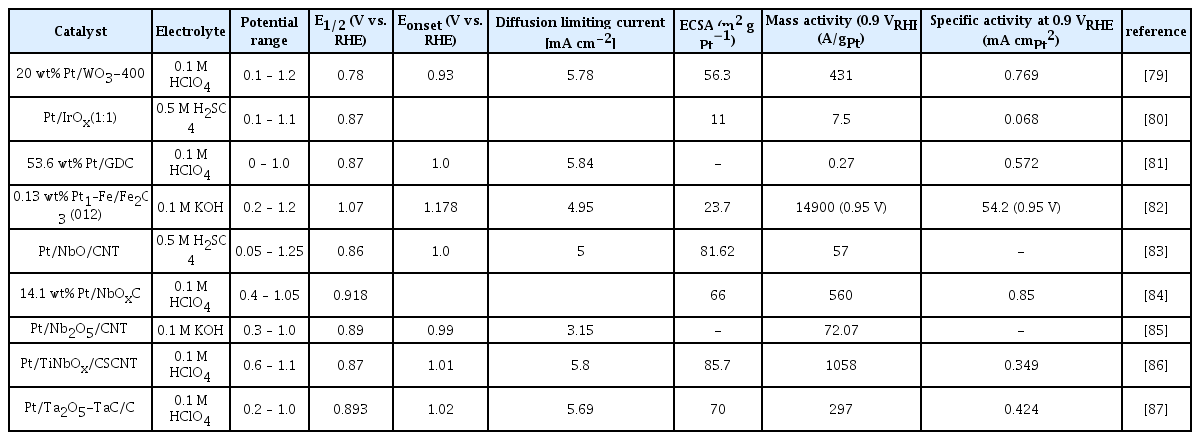
Kumar 그룹은 ORR 활성을 향상시키기 위해 수열합성법으로 합성한 WO3 nanorods 지지체를 열처리하여 Pt 나노입자에 균일하게 분산시키는 연구를 보고했다[79]. 투과전자현미경과 에너지분산형 분광분석법을 통해 400 °C에서 열처리했을 때 WO3 입자 모양이 변하지 않아 열적 안정성이 높다는 것과 Pt가 WO3에 균일하게 분포됨을 확인하였다. X선 광전자 분광법을 통해 Pt/WO3-400의 W 4f 피크가 WO3에 비해 더 높은 쪽으로 이동함을 확인하였다. 이러한 피크변동은 Pt 원자로 전자 밀도가 이동하여 산소 환원 능력을 향상시켰다. Pt/WO3는 Pt/C와 일치하는 ORR 성능을 보였으며 화학적 안정성 측면에서는 훨씬 우수하였다. Da Silva 그룹은 이기능성 산소 전극 촉매로 Pt/IrOx를 다양한 Pt:Ir 원자비(1:9, 3:7, 1:1)로 합성하였다[80]. 그 중 Pt:Ir=1:1 촉매가 가장 높은 활성을 보였다. Scanning flow cell inductively coupled mass spectrometry (SFCICP-MS) 및 identical location transmission electron microscopy (IL-TEM)를 통해 Ir이 많은 촉매일수록 용해도가 증가한다는 것을 확인하였다. 이를 해결하기 위해서는 IrOx의 결정도를 개선하는 것이 촉매활성과 안정성에 중요하다고 주장하였다. ECSA는 1:9 > 1:1 > 3:7 > Pt/C 순으로 증가하였으며 Pt 입자의 평균 크기와 반비례하였다. Shi 그룹은 Gd가 도핑된 CeO2 다면체의 (111)면을 따라 원자력적으로 방향이 정해진 Pt 나노로드를 포함하는 전기 촉매를 합성했다[81]. 밀도범함수이론 계산을 통해 Gd 도펀트에 의한 산소결손이 Pt/CeO2 접합을 조절하여 ORR활성 향상시킬 수 있음을 확인했다. 결과적으로 상용 Pt/C 촉매에 비해 4전자 ORR 성능이 크게 향상되고, 2전자 ORR 생성물인 H2O2는 적게 생성되었다. 이는 Pt 나노로드 구조의 표면에서 발생하는 (111)면의 노출로 인해 ORR 중간체인 OHad가 환원적으로 쉽게 탈착되어 O2 흡착 및 해리를 촉진하기 때문이다. Gao 그룹은 single site Pt의 단점을 극복하기 위해 α-Fe2O3에 Pt을 담지하여 Pt-Fe pair site를 구성한 Pt/Fe2O3촉매의 우수한 ORR활성을 보고하였다[82]. Pt와 Fe 사이의 전자간 상호작용으로 인해 pair site를 가져 높은 개시전위(1.15 V vs. RHE)와 반파장전위(1.05 V vs. RHE)로 우수한 ORR활성과 안정성을 갖는다. 이는 강력한 전자결합이 Pt-Fe pair site를 따라 부분적으로 점유된 궤도를 생성하여 O2 흡착 및 해리를 가속화하는 동시에 OH* 중간체가 Pt에서 탈착 되도록 하기 때문이다. Alipour 그룹은 NbO를 multi-walled carbon nanotubes (MCNTs)에 지지한 NbO/CNT 지지체 위에 Pt을 담지하여 전기활성이 높고 안정적인 촉매를 합성하였다[83]. 순환전압전류법을 통해 NbO의 수소 흡탈착 피크와 산화환원 전류피크가 관찰되지 않았다. 이는 NbO가 산성 매질에서 높은 안정성을 나타냄을 의미하며 가속 내구성 테스트와 전기화학 임피던스 분광법를 통해 확인하였다. 특히 NbO는 Pt 표면의 OH 흡착을 줄이고 지지체 표면에서 Pt가 용해되는 것을 방지할 수 있으며 CO 흡착을 감소시킨다. Ma 그룹은 탄소표면기공을 사용하여 고온에서 낮은 산화상태의 NbOx를 고정시킨 후 Pt을 선택적으로 증착하였다[84]. 탄소표면에 있는 나노기공에 Nb 전구체를 가두는 것이 잘 분산된 작은 입자를 생성할 뿐만 아니라 Nb(V)을 낮은 산화상태로 환원시킨다. 이는 지지체가 전기전도성을 향상시키는 탄소와의 접촉으로 ORR활성이 증가하며, Pt/C보다 높은 활성과 우수한 내구성을 갖는다. Shanmugapriya 그룹은 지지체와 촉진제 역할을 동시에 하는 Nb2O5를 사용하여 Pt/Nb2O5/CNT 촉매를 합성하였다[85]. 헤테로 구조인 Pt/Nb2O5/CNT는 SMSI를 제공하여 4전자 반응과 높은 반파장 전위를 통해 ORR활성이 향상됨을 확인하였다. 하지만 낮은 제한전류밀도(−3.15 mA cm−2)를 나타냈으며 이는 Pt 입자의 크기가 1.1 nm로 매우 작기 때문이다. Pt 나노입자 크기가 2–3 nm 미만일 경우 활성부위에서 ORR 활성의 손실을 초래한다. Ando 그룹은 d-band vacancy 증가가 ORR활성을 향상시킨다고 주장하였다[86]. 전자 상태를 변화시켜 다양한 전이금속 산화물(MOx, M1M2Ox, M = Ti, Nb, Ta, W, Y, Zr) 을 cup-stacked carbon nanotubes (CSCNTs)에 증착시켰고 이를 Pt 나노입자에 담지하였다. X선 광전자 분광법, 전자 에너지 손실 스펙트럼과 X-선 흡수 분광 분석법을 통해 금속산화물 지지체에서 Pt 나노입자로의 전자 공여가 SMSI로 이어짐을 확인하였다. 향상된 ORR활성을 위해 전기 촉매가 Pt보다 약 0.2 eV 산소와 약하게 결합해야 한다고 주장했다. 그 중 Pt/TiNbOx(Ti/Nb = 1:6.6)/CSCNT촉매의 d-band값(−3.59 eV)은 Pt/CB(−3.40 eV)보다 0.19 eV 낮았는데 이는 가장 높은 ORR활성을 보였다. 따라서 ORR활성과 d-band의 상관관계가 있음을 확인하였다. Gao 그룹은 800 − 1100 °C에서 열처리하여 높은 비표면적과 전기전도성을 갖는 중공-구형 구조를 갖는 Ta2O5-TaC 지지체를 합성하여 Pt에 담지한 촉매를 보고하였다[87]. Pt와 Ta2O5-TaC/C 사이의 전자간 상호작용은 X-선 흡수 분광분석법에 의해 확인된 바와 같이 Pt의 표면 전자 비편재화를 유도하여 O-O결합의 절단과 O2흡착을 촉진하여 ORR활성을 향상시킨다. 특히, Ta2O5-TaC/C는 Ta 화합물의 내구성 특성과 외부 Ta 화합물이 탄소를 보호하여 산성 매질에서 강하며 이는 AST 전후의 ECSA 비교(2.9% 감소)를 통해 확인하였다.
3. 결 론
촉매의 지지체는 촉매의 전기화학적 활성에 직접적인 영향을 준다. 현재 촉매 지지체에 대한 수많은 연구는 탄소에 중점적으로 연구되고 있다. 하지만 탄소 지지체에 담지된 Pt 입자 촉매는 고분자 전해질 연료전지의 높은 과전압에 의해 탄소 부식으로 이어진다. 따라서 탄소를 대신할 비탄소 지지체 촉매에 대한 연구의 필요성이 강화되고 있다. 본 논문에서는 최근 5년 이내에 보고된 금속산화물 지지체에 담지된 Pt 촉매(Pt/MO) 논문을 요약하였다. Pt/MO는 산화물의 산화 안정성 때문에 부식에 대한 저항성이 크다. 또한 Pt 나노입자와 산화물지지체 사이에 SMSI는 금속 나노입자를 구조적으로 안정시키기 때문에 적절한 지지체로 사용됨을 기대할 수 있다. 보고된 Pt/MO는 Pt/C보다 ORR성능이 비슷하거나 높은 성능을 보였으며, 안정성은 향상되었다. Pt/MO 중 Pt/TiO2, Pt/SnO2 촉매 합성에 관한 연구가 가장 활발히 이루어졌다. Pt/MO 촉매의 ORR 활성과 안정성을 향상시키기 위해 지지체의 구조, 비표면적 등을 향상시켰다. 그 중 도펀트를 사용하여 전기전도도를 향상시키는 논문이 많이 보고 되었다. 도펀트를 사용하면 지지체의 구조를 변화시켜 산소결손이 발생하며, 이는 전기 전도도 향상에 도움을 주어 ORR 활성 향상에 도움을 준다. 이와 같이 지지체는 촉매의 활성 및 내구성에 큰 영향을 주고 있으며 연료전지뿐만 아니라 높은 과전압 환경에서 사용되는 전기화학 촉매에 대해 큰 영향을 미친다. 본 논문의 내용이 이러한 전기화학 촉매 개발에 기여할 수 있을 것으로 보인다.
Acknowledgements
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구과제(No. 2020R1C1C1004206)이다.